AVASTIN®
ROCHE
Agente antineoplásico. Código ATC: L01XC07.
Composición.
Principio activo: bevacizumab (anticuerpo monoclonal humanizado anti-VEGF). Avastin se presenta en viales monodosis de 100 mg y 400 mg, sin conservantes, con 4 ml y 16 ml, respectivamente, de Avastin (25 mg/ml). Cada vial de Avastin de 100 mg contiene 100 mg de bevacizumab. Cada vial de Avastin de 400 mg contiene 400 mg de bevacizumab. Excipientes: v. Lista de excipientes. Forma farmacéutica: Concentrado para solución para infusión. Vía de administración: Líquido estéril límpido o ligeramente opalescente, incoloro o marrón claro, para infusión intravenosa (i.v.). Avastin no está formulado para uso intravítreo (ver Advertencias). Declaración de esterilidad / radiactividad: Producto estéril. Lista de excipientes: Trehalosa dihidrato, fosfato sódico, polisorbato, agua para inyectables.
Farmacología.
Propiedades farmacodinámicas: Mecanismo de acción: Avastin (bevacizumab) es un anticuerpo monoclonal humanizado recombinante que se une selectivamente al factor de crecimiento del endotelio vascular (VEGF) y neutraliza su actividad biológica. El bevacizumab contiene regiones de entramado (FR) humanas con regiones de unión al antígeno de un anticuerpo murino humanizado que se une al VEGF. El bevacizumab se produce por tecnología de ADN recombinante, mediante un sistema de expresión celular de mamífero de ovario de hámster chino en un medio nutritivo que contiene el antibiótico gentamicina, y se purifica en un proceso que incluye la inactivación y eliminación vírica. La gentamicina es detectable en el producto final en concentraciones ≤0,35 ppm. El bevacizumab tiene 214 aminoácidos y un peso molecular de aproximadamente 149.000 Da. Avastin inhibe la unión del VEGF a sus receptores, Flt-1 y KDR, en la superficie de las células endoteliales. La neutralización de la actividad biológica del VEGF reduce la vascularización de los tumores, lo que a su vez inhibe el crecimiento tumoral. La administración de bevacizumab o su anticuerpo murino parental a modelos de xenoinjerto de cáncer en ratones atímicos ("desnudos") se tradujo en una extensa actividad antitumoral en diversos tipos de cáncer humano, incluidos los de colon, mama, páncreas y próstata. La progresión de la enfermedad metastásica quedó inhibida y disminuyó la permeabilidad microvascular. Ensayos clínicos / Eficacia: Carcinoma colorrectal metastásico (CCRm): En tres estudios clínicos aleatorizados y controlados con tratamiento activo se estudiaron la seguridad y la eficacia de la dosis recomendada de Avastin (5 mg/kg cada dos semanas) en el carcinoma metastásico de colon o recto en combinación con quimioterapia de primera línea basada en fluoropirimidinas. Avastin se combinó con dos regímenes quimioterápicos: AVF2107g: una pauta semanal de irinotecán/5-fluorouracilo/leucovorina (ácido folínico) (régimen IFL) en bolo i.v., durante un total de 4 semanas de cada ciclo de 6 semanas. AVF0780g: en combinación con 5-fluorouracilo/leucovorina (5-FU/LV) en bolo i.v., durante un total de 6 semanas de cada ciclo de 8 semanas (régimen de Roswell Park). AVF2192g: en combinación con 5-fluorouracilo/leucovorina (5-FU/LV) en bolo i.v., durante un total de 6 semanas de cada ciclo de 8 semanas (régimen de Roswell Park) en pacientes que no eran candidatos óptimos para el tratamiento de primera línea con irinotecán. Se efectuaron otros tres estudios con Avastin en pacientes con CCRm: primera línea (NO16966), segunda línea sin tratamiento previo con Avastin (E3200) y segunda línea con tratamiento previo con Avastin tras la progresión de la enfermedad en el tratamiento de primera línea (ML18147). En estos estudios, Avastin se administró en los regímenes indicados a continuación en combinación con FOLFOX-4 (5-FU/LV/oxaliplatino) y XELOX (capecitabina/oxaliplatino) y fluoropirimidina/irinotecán o fluoropirimidina/oxaliplatino: NO16966: Avastin en una dosis de 7,5 mg/kg cada 3 semanas, en combinación con capecitabina oral y oxaliplatino i.v. (XELOX), o Avastin en una dosis de 5 mg/kg cada 2 semanas, en combinación con leucovorina + 5-fluorouracilo en bolo i.v., seguido de 5- fluorouracilo en infusión, y oxaliplatino i.v. (FOLFOX-4) en pacientes no tratados previamente con Avastin. E3200: Avastin en una dosis de 10 mg/kg cada 2 semanas, en combinación con leucovorina y 5-fluorouracilo en bolo i.v., seguido de 5-fluorouracilo en infusión, y oxaliplatino i.v. (FOLFOX-4). ML18147: Avastin en una dosis de 5,0 mg/kg cada 2 semanas o en una dosis de 7,5 mg/kg cada 3 semanas en combinación con fluoropirimidina/irinotecán o fluoropirimidina/oxaliplatino en pacientes con progresión de la enfermedad tras el tratamiento de primera línea con Avastin. El régimen con irinotecán u oxaliplatino se cambió en función del uso de oxaliplatino o irinotecán como tratamiento de primera línea. AVF2107g: Estudio clínico de fase III, aleatorizado, con doble enmascaramiento (doble-ciego) y controlado con tratamiento activo para evaluar Avastin en combinación con IFL como tratamiento de primera línea del carcinoma metastásico de colon o recto. Se aleatorizó a 813 pacientes para recibir IFL + placebo (grupo 1) o IFL + Avastin (5 mg/kg cada 2 semanas, grupo 2). Un tercer grupo de 110 pacientes recibieron 5-FU/LV en bolo i.v. + Avastin (grupo 3). Como se había especificado previamente, la inclusión en el grupo 3 se suspendió una vez conocida y considerada aceptable la seguridad de Avastin con el régimen de IFL. La variable principal de eficacia era la duración de la supervivencia global. La adición de Avastin a IFL se tradujo en un aumento estadísticamente significativo de la supervivencia global, la supervivencia sin progresión (SSP) y la tasa global de respuesta (ver detalles en Tabla 3). El beneficio clínico de Avastin, medido como supervivencia, se observó en todos los subgrupos predefinidos de pacientes, según edad, sexo, estado general, localización del cáncer primario, número de órganos afectados y duración de la enfermedad metastásica.
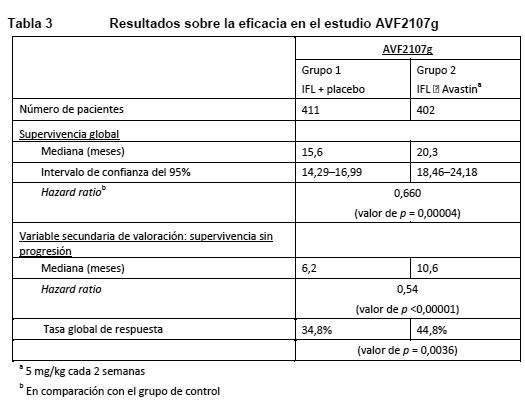
Entre los 110 pacientes aleatorizados al grupo 3 (5-FU/LV + Avastin) antes de la suspensión de este grupo, la mediana de la supervivencia global era de 18,3 meses, y la mediana de la supervivencia sin progresión de la enfermedad, de 8,8 meses. AVF2192g: Estudio clínico de fase II, aleatorizado, con doble enmascaramiento y controlado con tratamiento activo para evaluar Avastin en combinación con 5- FU/LV como tratamiento de primera línea del carcinoma colorrectal metastásico en pacientes que no eran candidatos óptimos para el tratamiento de primera línea con irinotecán. En total, 105 pacientes fueron aleatorizados al grupo de 5-FU/LV + placebo y 104 al grupo de 5-FU/LV + Avastin (5 mg/kg cada 2 semanas). Todos los tratamientos se mantuvieron hasta la progresión de la enfermedad. La adición de 5 mg/kg de Avastin cada dos semanas al régimen 5-FU/LV se acompañó de un aumento de la tasa de respuesta objetiva, una prolongación significativa de la supervivencia sin progresión y una tendencia a la prolongación de la supervivencia en comparación con la pauta 5-FU/LV sola. NO16966: Estudio clínico de fase III, aleatorizado, con doble enmascaramiento (para el bevacizumab), para evaluar Avastin en una dosis de 7,5 mg/kg en combinación con capecitabina oral y oxaliplatino i.v. (XELOX), con administración cada 3 semanas, o Avastin en una dosis de 5 mg/kg en combinación con leucovorina y 5-fluorouracilo en bolo i.v., seguido de 5-fluorouracilo en infusión y oxaliplatino i.v. (FOLFOX-4), con administración cada 2 semanas. Este estudio constaba de dos partes: una parte inicial desenmascarada con 2 grupos (parte I), en la que se aleatorizó a los pacientes entre dos grupos de tratamiento diferente (XELOX y FOLFOX-4), y una segunda parte de diseño factorial 2 x 2 con 4 grupos (parte II), en la que se aleatorizó a los pacientes entre cuatro grupos de tratamiento (XELOX + placebo, FOLFOX-4 + placebo, XELOX + Avastin, FOLFOX-4 + Avastin). En la parte II, la asignación de los pacientes fue de doble enmascaramiento con respecto a Avastin. En la parte II se aleatorizó a aproximadamente 350 pacientes en cada uno de los 4 grupos de estudio.
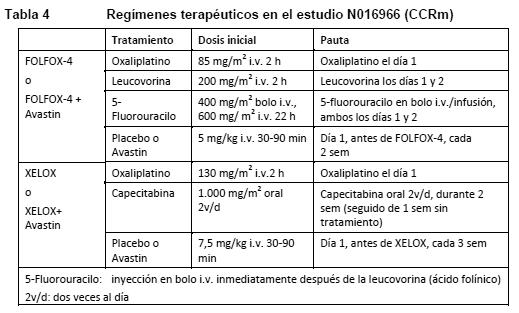
La variable principal de eficacia en este estudio era la duración de la supervivencia sin progresión de la enfermedad. Los objetivos principales de este estudio eran dos: demostrar la no inferioridad de XELOX respecto de FOLFOX-4 y demostrar que Avastin en combinación con la quimioterapia FOLFOX-4 o XELOX era superior a la quimioterapia sola. Se alcanzaron los dos objetivos principales: a) La no inferioridad de XELOX respecto de FOLFOX-4 en la comparación global de los grupos quedó demostrada en cuanto a la supervivencia sin progresión y la supervivencia global en la población seleccionable según protocolo. b) La superioridad de Avastin respecto de la quimioterapia sola en la comparación global de los grupos quedó demostrada en cuanto a la supervivencia sin progresión en la población con intención de tratar (población ITT) (Tabla 5). Los análisis secundarios de la supervivencia sin progresión, basados en la evaluación del Comité institucional de revisión y la respuesta basada en el tratamiento, confirmaron el beneficio clínico significativamente superior para los pacientes tratados con Avastin (análisis de subgrupos en la Tabla 5), concordante con el beneficio estadísticamente significativo observado en el análisis de datos agrupados.
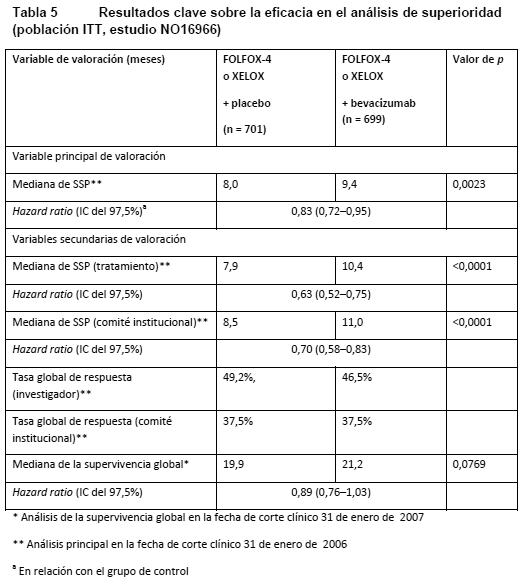
ECOG E3200: Estudio de fase III abierto, aleatorizado y controlado con tratamiento activo para evaluar Avastin en una dosis de 10 mg/kg en combinación con leucovorina, 5-fluorouracilo en bolo i.v., seguido de 5-fluorouracilo en infusión, y oxaliplatino i.v. (FOLFOX-4), administrado cada 2 semanas a pacientes tratados previamente (segunda línea) con carcinoma colorrectal avanzado. En los grupos de quimioterapia, el régimen FOLFOX-4 se aplicó con las mismas dosis e igual pauta que las mostradas en la Tabla 3 para el estudio NO16966. La variable principal de la eficacia de este estudio era la supervivencia global, definida como el tiempo transcurrido entre la aleatorización y el fallecimiento por cualquier causa. Se aleatorizó a 829 pacientes (FOLFOX-4: 292; Avastin + FOLFOX-4: 293; Avastin en monoterapia: 244). La adición de Avastin a FOLFOX-4 se tradujo en una prolongación de la supervivencia estadísticamente significativa. También se observaron mejoras estadísticamente significativas de la supervivencia sin progresión de la enfermedad y de la tasa de respuesta objetiva (ver Tabla 6).
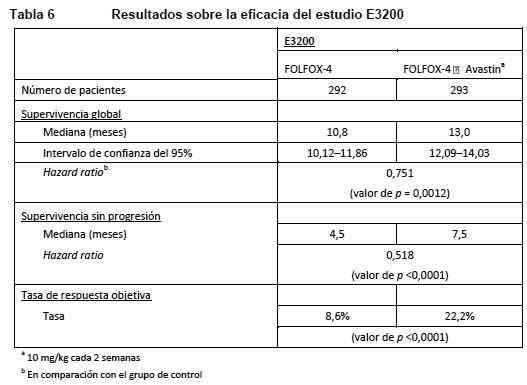
No se observó ninguna diferencia significativa en la duración de la supervivencia global entre los pacientes que habían recibido Avastin en monoterapia y los tratados con FOLFOX-4. La supervivencia sin progresión y la tasa de respuesta objetiva fueron menores en el grupo de Avastin en monoterapia que en el grupo de FOLFOX-4. ML18147: Fue un estudio de fase III, abierto, aleatorizado y controlado, sobre Avastin en una dosis de 5,0 mg/kg cada 2 semanas o 7,5 mg/kg cada 3 semanas en combinación con quimioterapia basada en fluoropirimidinas frente a quimioterapia basada en fluoropirimidinas sola en pacientes con cáncer colorrectal metastásico en progresión tras un régimen de primera línea que contenía Avastin. Los pacientes con CCRm histológicamente confirmado y progresión de la enfermedad fueron aleatorizados 1:1 dentro de los 3 meses siguientes a la suspensión del tratamiento de primera línea con Avastin para recibir quimioterapia basada en fluoropirimidina/oxaliplatino o fluoropirimidina/irinotecán (cambio de la quimioterapia en función de la quimioterapia de primera línea) con o sin Avastin. Los pacientes recibieron tratamiento hasta la progresión de la enfermedad o toxicidad inaceptable. La variable principal de valoración fue la supervivencia global (SG) definida como el tiempo transcurrido hasta la muerte por cualquier causa. Se aleatorizó a un total de 820 pacientes. La adición de Avastin a la quimioterapia basada en fluoropirimidinas se tradujo en una prolongación estadísticamente significativa de la supervivencia de los pacientes con CCRm cuya enfermedad había progresado tras un régimen de primera línea que contenía Avastin (ITT=819) (ver Tabla 7).
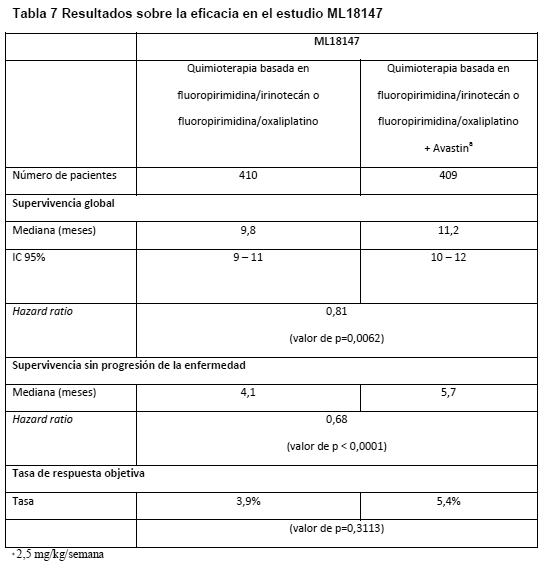
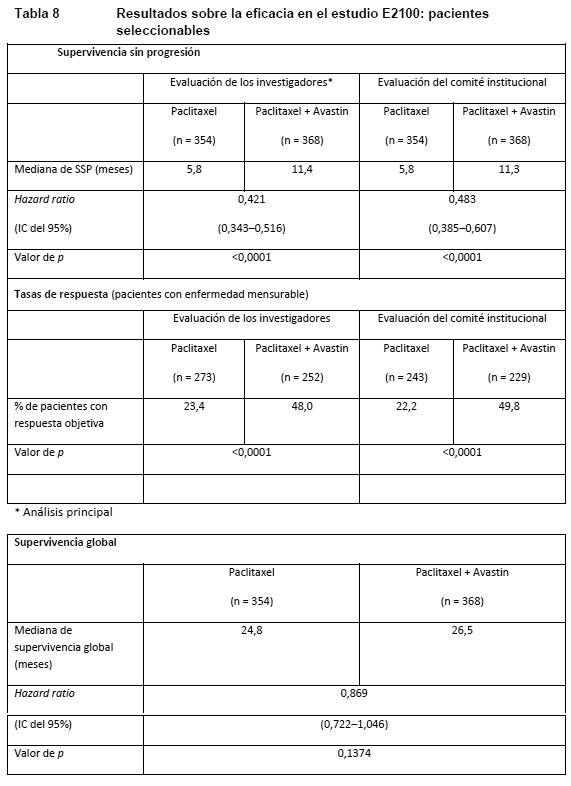
También se observó una mejora estadísticamente significativa de la supervivencia sin progresión. La tasa de respuesta objetiva fue baja en ambos grupos de tratamiento y no alcanzó significación estadística. Cáncer de colon, tratamiento adyuvante (CCa): BO17920: Estudio de fase III aleatorizado, abierto, con 3 tres grupos, en una población de 3.451 pacientes con carcinoma de colon de alto riesgo en estadios II o III, en el que se evaluaban la eficacia y la seguridad de Avastin en una dosis equivalente a 2,5 mg/kg/semana cada 2 semanas en combinación con FOLFOX-4 o cada 3 semanas en combinación con XELOX frente a FOLFOX-4 en monoterapia como quimioterapia adyuvante. En los dos grupos de Avastin se observaron más recaídas y muertes a causa de la progresión de la enfermedad que en el grupo de control. El objetivo principal de prolongar la supervivencia sin enfermedad (SSE) de los pacientes con cáncer de colon en estadio III (n=2.867) agregando Avastin a cualquiera de los regímenes quimioterápicos no se alcanzó. La hazard ratio de la SSE fue de 1,17 (IC del 95%: 0,98 - 1,39) en el grupo de FOLFOX-4 + Avastin y de 1,07 (IC del 95%: 0,90 - 1,28) en el grupo de XELOX + Avastin. Carcinoma de mama localmente recurrente o metastásico (CMm): ECOG E2100: E2100 fue un estudio abierto, aleatorizado y controlado con tratamiento activo, en el que se evaluó Avastin en combinación con paclitaxel contra el carcinoma de mama localmente recurrente o metastásico en pacientes que no habían recibido antes quimioterapia por enfermedad localmente recurrente y metastásica. Hormonoterapia previa contra la enfermedad metastásica estaba permitida. La administración adyuvante de taxanos sólo estaba permitida si había concluido al menos 12 meses antes de la incorporación al estudio. Se aleatorizó a las pacientes para recibir paclitaxel solo (90 mg/m2 i.v. en 1 hora, una vez por semana, durante tres o cuatro semanas) o en combinación con Avastin (10 mg/kg en infusión i.v., cada dos semanas). Las pacientes debían continuar con el tratamiento en estudio asignado hasta la progresión de la enfermedad. En los casos en los que las pacientes abandonaron prematuramente la quimioterapia, el tratamiento con Avastin en monoterapia prosiguió hasta la progresión de la enfermedad. La variable principal de valoración era la supervivencia sin progresión (SSP) según la evaluación de los investigadores. Complementariamente, un Comité institucional de revisión evaluó también la variable principal de valoración. La mayoría (90%) de las 722 pacientes del estudio presentaban negatividad para HER2. En algunas de ellas se desconocía la positividad o negatividad para HER2 (8%) y un pequeño número presentaba positividad (2%). Las pacientes HER2-positivas habían sido tratadas previamente con trastuzumab o no se las consideraba idóneas para recibir trastuzumab. La mayoría (65%) habían recibido quimioterapia adyuvante: un 19% con taxanos y un 49% con antraciclinas. Las características de las pacientes eran similares en ambos grupos de estudio. Los resultados del estudio se presentan en la Tabla 8.
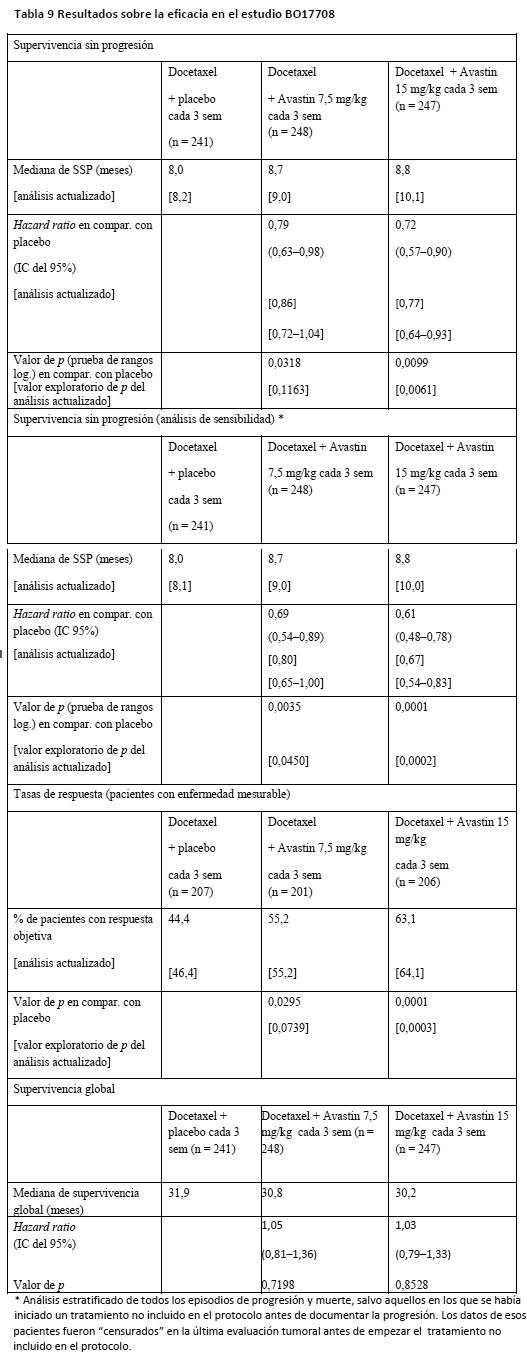
BO17708: BO17708 fue un estudio de fase III multicéntrico, aleatorizado, con doble enmascaramiento y controlado con placebo para evaluar la eficacia y la seguridad de Avastin en combinación con docetaxel en comparación con docetaxel + placebo como tratamiento de primera línea de pacientes con carcinoma de mama HER2- metastásico o localmente recurrente que no habían recibido previamente quimioterapia contra su enfermedad metastásica. Se aleatorizó a las pacientes en la proporción 1:1:1 para recibir uno de los regímenes siguientes: placebo + docetaxel 100 mg/m2 cada 3 semanas. Avastin 7,5 mg/kg + docetaxel 100 mg/m2 cada 3 semanas. Avastin 15 mg/kg + docetaxel 100 mg/m2 cada 3 semanas. La administración de docetaxel se limitó a un máximo de 9 ciclos, mientras que la de Avastin y placebo prosiguió hasta la progresión de la enfermedad, el fallecimiento o una toxicidad inaceptable. Las características de la enfermedad y de las pacientes eran similares en los tres grupos. En presencia de progresión documentada de la enfermedad, las pacientes de los tres grupos terapéuticos podían pasar a una fase de tratamiento postestudio en la que recibieron Avastin en régimen abierto junto con un amplio arco de terapias de segunda línea. La variable principal de valoración era la supervivencia sin progresión evaluada por los investigadores. Para evaluar las variables principales de la eficacia, se realizaron dos comparaciones: Avastin 7,5 mg/kg + docetaxel 100 mg/m2 cada 3 semanas frente a placebo + docetaxel 100 mg/m2 cada 3 semanas. Avastin 15 mg/kg + docetaxel 100 mg/m2 cada 3 semanas frente a placebo + docetaxel 100 mg/m2 cada 3 semanas. Los resultados del estudio se presentan en la Tabla 8. En la supervivencia sin progresión y las tasas de respuesta están incluidos los resultados del análisis final preespecificado y los de un análisis exploratorio (actualizado) efectuado al mismo tiempo que el análisis final predefinido de la supervivencia global, que incluía 18 meses adicionales de seguimiento. Los resultados de la supervivencia global presentados son los del análisis final predefinido de la supervivencia global. En ese momento habían fallecido aproximadamente el 45% de las pacientes de todos los grupos de tratamiento. El análisis actualizado muestra lo siguiente: Avastin 15 mg/kg cada 3 semanas + docetaxel va asociado sistemáticamente a mejores resultados primarios y secundarios de eficacia, con una seguridad similar, que Avastin 7,5 mg/kg cada 3 semanas + docetaxel. Avastin 7,5 mg/kg cada 3 sem. + docetaxel no arroja mejores resultados que las terapias de control en cuanto a SSP y tasas de respuesta. Por consiguiente, se recomienda la dosis de 15 mg/kg cada 3 semanas para el tratamiento de las pacientes con CMm (ver Dosificación).
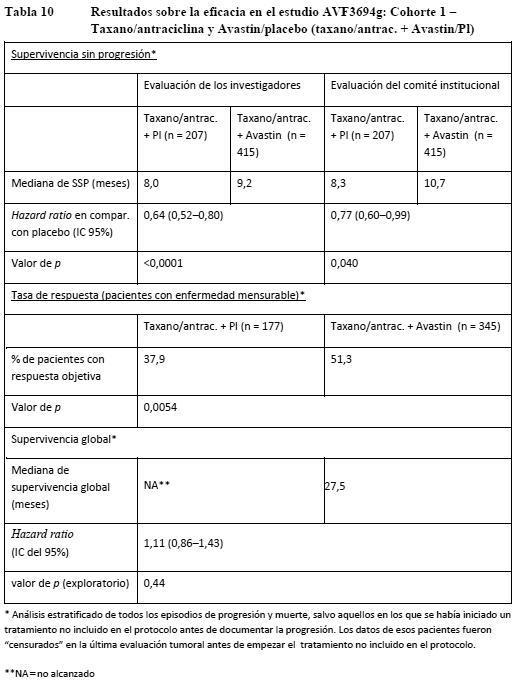
AVF3694g: AVF3694g era un estudio de fase III, multicéntrico, aleatorizado y controlado con placebo, diseñado para evaluar la eficacia y la seguridad de Avastin en combinación con quimioterapia en comparación con quimioterapia + placebo como tratamiento de primera línea del carcinoma de mama HER2-negativo metastásico o localmente recurrente. El investigador eligió la quimioterapia según su propio criterio antes de la aleatorización de las pacientes en la proporción de 2:1 para recibir quimioterapia + Avastin o quimioterapia + placebo. Las opciones quimioterápicas consistían en taxanos (docetaxel o paclitaxel ligado a proteínas), politerapia antraciclínica (doxorrubicina/ ciclofosfamida, epirrubicina/ ciclofosfamida, 5-fluorouracilo/ doxorrubicina/ ciclofosfamida, 5-fluorouracilo/ epirrubicina/ ciclofosfamida) o capecitabina una vez cada tres semanas. Avastin y placebo se administraron a razón de 15 mg/kg cada 3 semanas. Este estudio comprendía una fase de tratamiento enmascarado (ciego), una fase abierta postprogresión optativa y una fase de seguimiento de la supervivencia. Durante la fase de tratamiento enmascarado, las pacientes recibieron quimioterapia y el producto en estudio (Avastin o placebo) cada 3 semanas hasta la progresión de la enfermedad, la presencia de toxicidad limitante de la dosis o el fallecimiento. En presencia de progresión documentada de la enfermedad, pacientes que se hallaban en la fase abierta optativa podían recibir en régimen abierto con Avastin junto con un amplio arco de terapias de segunda línea. Los porcentajes de pacientes de cada grupo que recibieron Avastin en régimen abierto fueron: taxano/antrac. + placebo: 43,0%, taxano/antrac. + Avastin: 29,6% y capec. + placebo: 51,9%, capec. + Avastin 34,7%. El análisis de las pacientes se realizó en las dos cohortes siguientes, según el tratamiento recibido: Pacientes que recibieron taxano/antrac. + Avastin/placebo (taxano/antrac. + Avastin/Pl): cohorte 1. Pacientes que recibieron capecitabina + Avastin/placebo (capec. + Avastin/Pl: cohorte 2. La variable principal de valoración era la supervivencia sin progresión según la evaluación del investigador de 1) pacientes tratadas con un taxano o un régimen antraciclínico (cohorte 1), y 2) pacientes tratadas con capecitabina (cohorte 2). La dotación de potencia estadística se realizó independientemente en cada cohorte. Complementariamente, un Comité institucional de revisión evaluó también la variable principal de valoración. En la Tabla 9 (cohorte 1) y la Tabla 10 (cohorte 2) se muestran los resultados de este estudio obtenidos en los análisis finales definidos en el protocolo para la supervivencia sin progresión y las tasas de respuesta. También se presentan los resultados en ambas cohortes de un análisis exploratorio de la supervivencia global en el que se incluyeron 7 meses adicionales de seguimiento. En ese momento habían fallecido aproximadamente el 45% de las pacientes de todos los grupos de tratamiento.
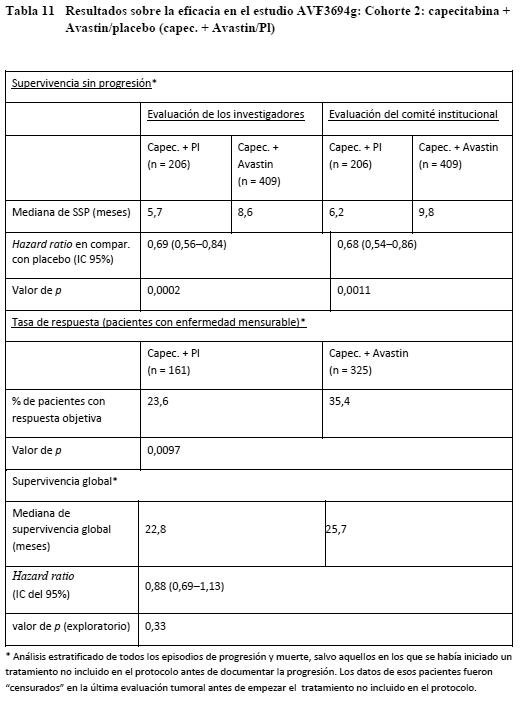
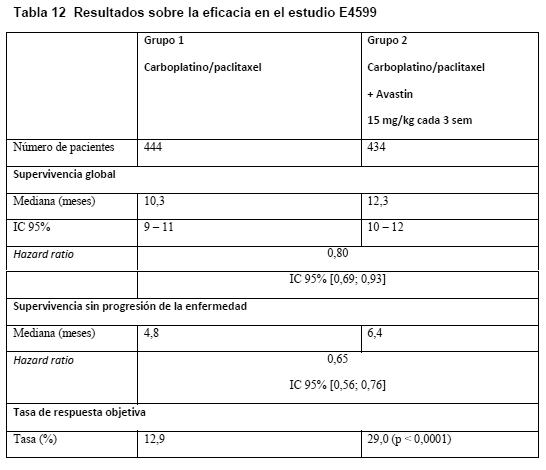
De ambas cohortes se realizó un análisis no estratificado de la SSP (evaluación de los investigadores) en el que no se censuraron los datos del tratamiento no incluido en el protocolo antes de la progresión de la enfermedad. Los resultados de estos análisis fueron similares a los del análisis principal de la SSP. Carcinoma pulmonar no microcítico (CPNM) avanzado, metastásico o recurrente: En los estudios E4599 y BO17704 se evaluaron la seguridad y la eficacia de Avastin como tratamiento de primera línea del CPNM no predominantemente escamoso, además de la quimioterapia basada en platino. E4599: E4599 era un estudio clínico multicéntrico, abierto, aleatorizado y controlado con tratamiento activo en el que se evaluó Avastin como tratamiento de primera línea del CPNM localmente avanzado, metastásico o recurrente que no fuera de tipo predominantemente escamoso. Se aleatorizó a los pacientes para recibir quimioterapia basada en platino (paclitaxel [200 mg/m2] y carboplatino [ABC de 6,0], ambos en infusión i.v. [PC]) el día 1 de cada ciclo de 3 semanas, hasta 6 ciclos, o PC en combinación con Avastin en una dosis de 15 mg/kg en infusión i.v. el día 1 de cada ciclo de 3 semanas. Después de completados seis ciclos de quimioterapia con carboplatino/paclitaxel o tras la suspensión prematura de la quimioterapia, los pacientes del grupo de Avastin + carboplatino/paclitaxel siguieron recibiendo Avastin en monoterapia durante 3 semanas hasta la progresión de la enfermedad. El total de pacientes aleatorizados entre los dos grupos fue de 878. De los pacientes que recibieron el tratamiento ensayado, el 32,2% (136/422) recibieron 7-12 administraciones de Avastin, y el 21,1% (89/422), 13 o más. La variable principal de valoración era la duración de la supervivencia. Los resultados se presentan en la Tabla 12.
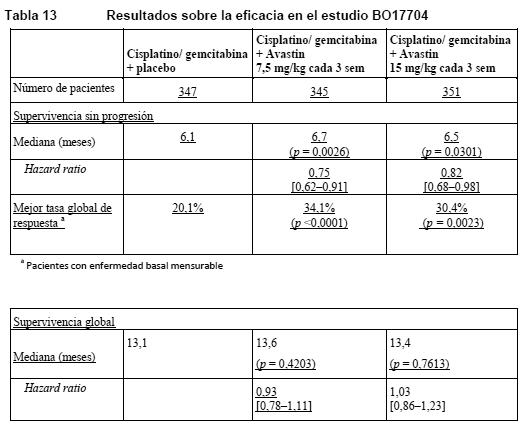
BO17704: BO17704 fue un estudio de fase III aleatorizado y con doble enmascaramiento de Avastin agregado a cisplatino y gemcitabina frente a placebo, cisplatino y gemcitabina en pacientes con CPNM no escamoso localmente avanzado, metastásico o recurrente que no habían recibido quimioterapia con anterioridad. La variable principal de valoración era la supervivencia sin progresión, y entre las variables secundarias se hallaba la duración de la supervivencia global. Se aleatorizó a los pacientes para recibir quimioterapia basada en platino (80 mg/m2 de cisplatino en infusión i.v. el día 1 y 1.250 mg/m2 de gemcitabina en infusión i.v. los días 1 y 8 de cada ciclo de 3 semanas hasta 6 ciclos [CG]) con placebo o CG con Avastin en una dosis de 7,5 mg/kg en infusión i.v. el día 1 de cada ciclo de 3 semanas. En los grupos de Avastin, los pacientes podían recibir Avastin en monoterapia cada 3 semanas hasta la progresión de la enfermedad o hasta el desarrollo de toxicidad inaceptable. Los resultados muestran que el 94% (277/296) de los pacientes seleccionables pasaron a recibir bevacizumab en monoterapia en el ciclo 7. Una alta proporción de los pacientes (aproximadamente el 62%) pasaron a recibir diversos tratamientos antineoplásicos no especificados en el protocolo, que pueden haber influido en los resultados analíticos de la supervivencia global. Los resultados sobre la eficacia se presentan en la Tabla 13.
Carcinoma de células renales avanzado y/o metastásico (CRm): BO17705: BO17705 fue un estudio de fase III multicéntrico, aleatorizado y de doble-ciego para evaluar la eficacia y la seguridad de Avastin en combinación con IFN alfa-2a (Roferon®) frente a IFN alfa-2a solo como tratamiento de primera línea del CRm. Los 649 pacientes aleatorizados (641 tratados) presentaban CRm de células claras, un índice de Karnofsky (KPS) > 70%, ausencia de metástasis del SNC y una función orgánica adecuada. Se administró IFN alfa-2a (3 veces por semana, en la dosis recomendada de 9 MUI) + Avastin (10 mg/kg cada 2 semanas) o placebo hasta la progresión de la enfermedad. Se estratificó a los pacientes por países y según la clasificación de Motzer, y los grupos de tratamiento estaban bien equilibrados en cuanto a factores pronóstico. La variable principal de valoración era la supervivencia global y entre las variables secundarias se hallaba la supervivencia sin progresión. La adición de Avastin a IFN alfa-2a incrementó significativamente la supervivencia sin progresión y la tasa de respuesta objetiva del tumor. Una evaluación radiológica independiente confirmó estos resultados. Ahora bien, el incremento de 2 meses de la variable principal de valoración no era significativo (HR = 0,91). Una alta proporción de los pacientes (aproximadamente el 63% del grupo IFN/placebo y el 55% del grupo Avastin/IFN) recibieron diversos tratamientos contra el cáncer no especificados, posteriores al protocolo, incluidos agentes antineoplásicos, que pueden haber influido en los resultados analíticos de la supervivencia global. Los resultados sobre la eficacia se presentan en la Tabla 14.
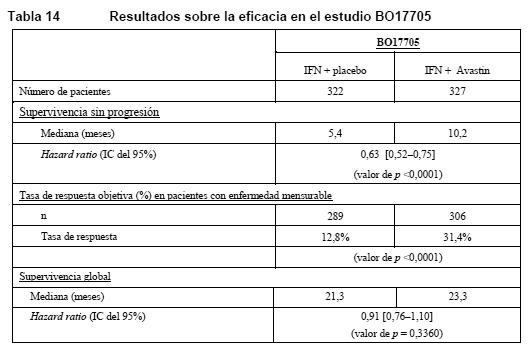
De acuerdo con un modelo de análisis multifactorial exploratorio de regresión de Cox con selección regresiva, los siguientes factores pronósticos basales estaban fuertemente asociados con la supervivencia independientemente del tratamiento: sexo, recuento leucocitario, pérdida de peso corporal en los 6 meses previos a la incorporación al estudio, número de localizaciones metastásicas, suma del diámetro mayor de las lesiones diana, puntuación de Motzer. El ajuste por estos factores basales arrojó una hazard ratio para el tratamiento de 0,78 (IC del 95% [0,63- 0,96], p = 0,0219), indicativa de una reducción del riesgo de fallecimiento del 22% en el grupo de Avastin + IFN alfa-2a en comparación con el grupo de IFN alfa-2a. Noventa y siete (97) pacientes del grupo de IFN alfa-2a y 131 del grupo de Avastin redujeron la dosis de IFN alfa-2a de 9 MUI a 6 o 3 MUI tres veces por semana, como se especificaba en el protocolo. La reducción de la dosis de IFN alfa-2a no pareció afectar a la eficacia de la combinación de Avastin e IFN alfa-2a de acuerdo con las tasas de SSP sin acontecimientos adversos, como puso de manifiesto el análisis de un subgrupo. Los 131 pacientes de grupo de Avastin + IFN alfa-2a que redujeron y mantuvieron la dosis de IFN alfa-2a en 6 o 3 MUI durante el estudio tenían tasas de SSP sin acontecimientos adversos del 73%, 52% y 21% a los 6, 12 y 18 meses, respectivamente, frente al 61%, 43% y 17% en la población total tratada con Avastin + IFN alfa-2a. AVF2938: Estudio de fase II aleatorizado y con doble enmascaramiento para evaluar Avastin en una dosis de 10 mg/kg cada 2 semanas y la misma dosis de Avastin en combinación con 150 mg diarios de erlotinib en pacientes con CRm de células claras. Se aleatorizó a un total de 104 pacientes en este estudio: 53 al grupo de Avastin en una dosis de 10 mg/kg cada dos semanas + placebo y 51 al grupo de Avastin en una dosis de 10 mg/kg cada dos semanas + 150 mg diarios de erlotinib. El análisis de la variable principal de valoración no reveló ninguna diferencia entre el grupo de Avastin + placebo y el de Avastin + erlotinib (mediana de PFS: 8,5 meses frente a 9,9). Siete pacientes de cada grupo tuvieron una respuesta objetiva. Gliomas malignos (grado IV de la OMS): glioblastoma: AVF3708g: La eficacia y la seguridad de Avastin como tratamiento de pacientes con glioblastoma se ha estudiado en un estudio abierto, multicéntrico, aleatorizado y no comparativo (estudio AVF3708g). A pacientes con glioblastoma en primera o segunda recidiva tras recibir radioterapia (finalizada al menos 8 semanas antes de la administración de Avastin) y temozolomida se los aleatorizó (1:1) para recibir Avastin (10 mg/kg en infusión i.v. cada 2 semanas) o Avastin + irinotecán (125 mg/m2 i.v. o 340 mg/m2 i.v. en pacientes tratados con antiepilépticos enzimoinductores cada 2 semanas) hasta la progresión de la enfermedad o hasta que la toxicidad fuera inaceptable. Las variables principales de valoración del estudio eran la supervivencia sin progresión a los 6 meses y la tasa de respuesta objetiva evaluadas por un Comité institucional independiente. Otras variables de valoración fueron la duración de la supervivencia sin progresión, la duración de la respuesta y la supervivencia global. En la Tabla 14 se resumen los resultados del estudio.
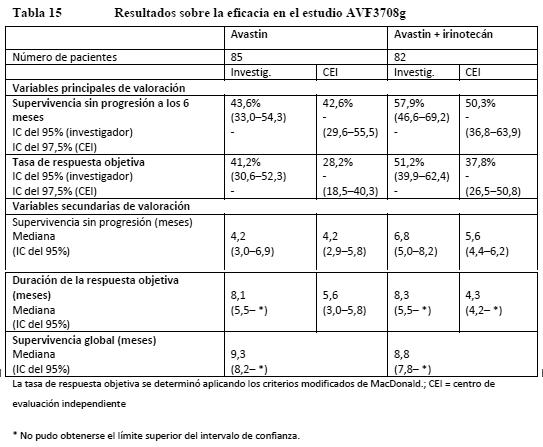
En el estudio AVF3708g, la SSP a los seis meses basada en las evaluaciones del CEI fue significativamente mayor (p < 0,0001) que con los controles históricos en ambos grupos de tratamiento: 42,6% en el grupo de Avastin y 50,3% en el grupo de Avastin + irinotecán (evaluación del investigador: 43,6% en el grupo de Avastin y 57,9% en el grupo de Avastin + irinotecán). Las tasas de respuesta objetiva también fueron significativamente más altas (p < 0,0001) que con los controles históricos en ambos grupos de tratamiento: 28,2% en el grupo de Avastin y 37,8% en el grupo de Avastin + irinotecán (evaluación del investigador: 41,2% en el grupo de Avastin y 51,2% en el grupo de Avastin + irinotecán). La mayoría de los pacientes que estaban recibiendo corticosteroides al inicio del estudio, incluidos respondedores y no respondedores, pudieron reducir con el tiempo su utilización mientras duró la administración de bevacizumab. La mayoría de los pacientes que tuvieron una respuesta objetiva o una SSP prolongada (en la semana 24) mantuvieron o mejoraron sus funciones neurocognitivas durante el tratamiento en estudio en comparación con la situación basal. La mayoría de los pacientes que permanecieron en el estudio y no presentaban progresión de la enfermedad en la semana 24 tenían un índice de Karnofsky que se mantuvo estable. Cáncer epitelial de ovario, cáncer de las trompas de Falopio y cáncer peritoneal primario: Cáncer de ovario, tratamiento de primera línea: La eficacia y la seguridad de Avastin en el tratamiento de primera línea de pacientes con cáncer epitelial de ovario, cáncer de las trompas de Falopio o cáncer peritoneal primario se estudió en dos ensayos clínicos de fase III (GOG-0218 y BO17707) en los que se comparó el efecto de añadir Avastin a carboplatino y paclitaxel con un régimen quimioterápico solo. GOG-0218: GOG-0218 era un estudio de fase III multicéntrico, aleatorizado, con doble enmascaramiento, controlado con placebo y de tres grupos, en el que se evaluaba el efecto de agregar Avastin a un régimen quimioterápico aprobado (carboplatino y paclitaxel) en pacientes con cáncer epitelial de ovario, cáncer de las trompas de Falopio o cáncer peritoneal primario en estadio III o IV que habían sido sometidos a cirugía citorreductora óptima o subóptima. Se asignó aleatorizadamente a un total de 1.873 pacientes, en igual proporción, a uno de los tres grupos siguientes: CPP: placebo en combinación con carboplatino (ABC = 6) y paclitaxel (175 mg/m2) durante 6 ciclos, seguido de placebo solo, durante un total de hasta 15 meses de tratamiento. CPB15: cinco ciclos de Avastin (15 mg/kg cada 3 semanas) en combinación con carboplatino (ABC = 6) y paclitaxel (175 mg/m2) durante 6 ciclos (Avastin iniciado en el ciclo 2 de quimioterapia), seguido de placebo solo, durante un total de hasta 15 meses de tratamiento. CPB15+: cinco ciclos de Avastin (15 mg/kg cada 3 semanas) en combinación con carboplatino (ABC = 6) y paclitaxel (175 mg/m2) durante 6 ciclos (Avastin iniciado en el ciclo 2 de quimioterapia), seguido del uso continuo de Avastin (15 mg/kg c3s) en monoterapia durante un total de hasta 15 meses de tratamiento. La variable principal de valoración era la supervivencia sin progresión evaluada por los investigadores de acuerdo con los resultados radiológicos. Complementariamente, un Comité institucional de revisión evaluó también la variable principal de valoración. Los resultados del estudio se presentan en la Tabla 16.
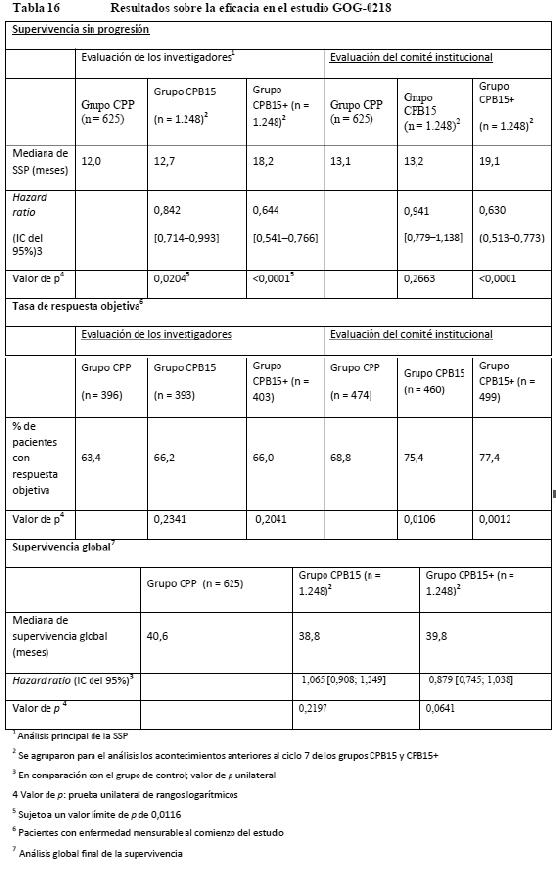
El estudio alcanzó el objetivo principal de mejora de la SSP. En comparación con los pacientes tratados solo con quimioterapia (carboplatino y paclitaxel), los que recibieron tratamiento de primera línea con bevacizumab en una dosis de 15 mg/kg cada 3 semanas en combinación con quimioterapia y siguieron recibiendo bevacizumab en monoterapia experimentaron una mejora de la SSP clínicamente importante y estadísticamente significativa. Aunque se observó una mejora de la SSP en los pacientes tratados con bevacizumab en primera línea en combinación con quimioterapia y no siguieron recibiendo bevacizumab en monoterapia, la mejora no fue ni clínicamente importante ni estadísticamente significativa en comparación con los tratados con quimioterapia sola. BO17707 (ICON7): BO17707 era un estudio de fase III abierto, con dos grupos, multicéntrico, aleatorizado y controlado, en el que se compararon los efectos de agregar Avastin a carboplatino + paclitaxel en pacientes con cáncer epitelial de ovario, cáncer de las trompas de Falopio o cáncer peritoneal primario en estadios I o IIA de la FIGO (grado 3 o histología de células claras solamente) o estadios IIB - IV de la FIGO (todos los grados y todos los tipos histológicos) tras la cirugía y en los que no estaba programa una nueva intervención quirúrgica antes de la progresión. Se aleatorizó a un total de 1.528 pacientes en igual proporcional a uno de los dos grupos siguientes: CP: carboplatino (ABC = 6) y paclitaxel (175 mg/m2) durante 6 ciclos. CPB7.5+: carboplatino (ABC = 6) y paclitaxel (175 mg/m2) durante 6 ciclos + Avastin (7,5 mg/kg cada 3 semanas) hasta 18 ciclos. La variable principal de valoración era la supervivencia sin progresión (SSP) evaluada por los investigadores. Los resultados del estudio se presentan en la Tabla 17.
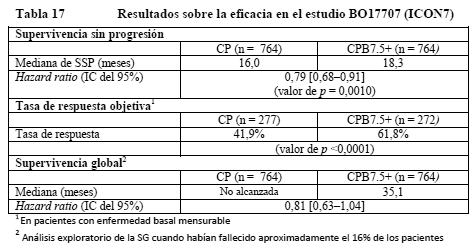
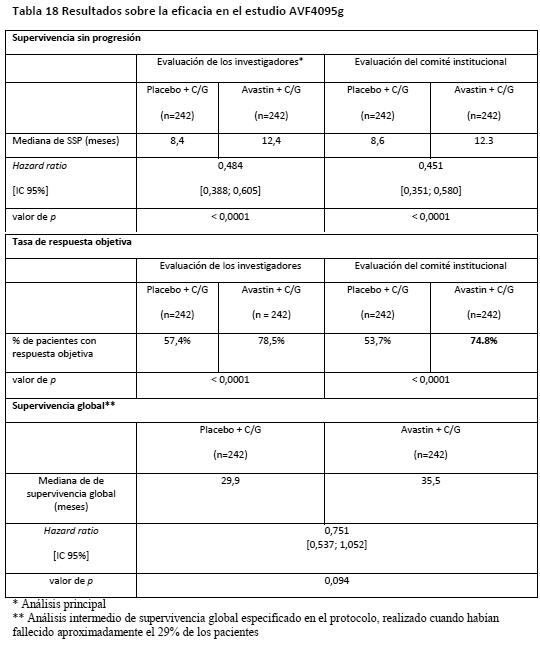
El estudio alcanzó el objetivo principal de mejora de la SSP. En comparación con los pacientes tratados solo con quimioterapia (carboplatino y paclitaxel), los que recibieron bevacizumab en una dosis de 7,5 mg/kg cada 3 semanas en combinación con quimioterapia y siguieron recibiendo bevacizumab hasta 18 ciclos experimentaron una mejora de la SSP estadísticamente significativa. Cáncer de ovario recidivante: AVF4095g: En un estudio de fase III aleatorizado, de doble-ciego y controlado con placebo (AVF4095g) se evaluaron la seguridad y la eficacia de Avastin en el tratamiento de pacientes con cáncer epitelial de ovario, cáncer de las trompas de Falopio o cáncer peritoneal primario sensibles al platino que no que habían recibido antes quimioterapia contra una recidiva o tratamiento con bevacizumab. En este estudio se comparó el efecto de agregar Avastin a la quimioterapia con carboplatino y gemcitabina y proseguir con Avastin en monoterapia hasta la progresión de la enfermedad con el efecto de administrar solo carboplatino y gemcitabina. Un total de 484 pacientes con enfermedad mensurable fueron asignados aleatorizadamente a dos grupos iguales: Carboplatino (ABC4, día 1) y gemcitabina (1.000 mg/m2 los días 1 y 8) y concomitantemente placebo cada 3 semanas durante 6 ciclos y hasta 10 ciclos, siguiendo con placebo solo hasta la progresión de la enfermedad o toxicidad inaceptable. Carboplatino (ABC4, día 1) y gemcitabina (1.000 mg/m2 los días 1 y 8) y concomitantemente Avastin (15 mg/kg el día 1) cada 3 semanas durante 6 ciclos y hasta 10 ciclos, siguiendo con Avastin (15 mg/kg cada 3 semanas) en monoterapia hasta la progresión de la enfermedad o toxicidad inaceptable. La variable principal de valoración era la supervivencia sin progresión (SSP) según la evaluación de los investigadores aplicando los criterios RECIST. Otras variables de valoración adicionales eran la respuesta objetiva, la duración de la respuesta, la seguridad y la supervivencia global. Un Comité institucional de revisión evaluó también la variable principal de valoración. Los resultados del estudio se presentan en la Tabla 18.
Propiedades farmacocinéticas: Se estudió la farmacocinética del bevacizumab en pacientes con diversos tipos de tumores sólidos. Las dosis evaluadas fueron de 0,1-10 mg/kg semanalmente en los estudios de fase I; 3-20 mg/kg cada dos o tres semanas en los estudios de fase II; 5 mg/kg cada 2 semanas o 15 mg/kg cada 3 semanas en los estudios de fase III. En todos los estudios, el bevacizumab se administró en infusión i.v. Como en otros anticuerpos, la farmacocinética del bevacizumab corresponde a la de un modelo bicompartimental. En el conjunto de los estudios clínicos, la disposición del bevacizumab se caracterizó por un aclaramiento bajo, un volumen reducido del compartimiento central (Vc) y una semivida de eliminación larga. Estas características permiten mantener la concentración plasmática deseada de bevacizumab con diversas pautas de administración (por ejemplo: cada 2 o 3 semanas). En el análisis de farmacocinética poblacional no había ninguna diferencia significativa en la farmacocinética del bevacizumab respecto de la edad (ausencia de correlación entre el aclaramiento del bevacizumab y la edad del paciente [la mediana de edad era de 59 años, con los percentiles 5 y 95 de 37 y 76 años]). Una concentración baja de albúmina y una masa tumoral grande suelen ser indicativas de gravedad de la enfermedad. El aclaramiento del bevacizumab fue aproximadamente un 30% más rápido en los pacientes con cifras bajas de albúmina sérica y un 7% más rápido en los pacientes con una masa tumoral grande en comparación con un paciente típico con valores medianos de albúmina y masa tumoral. Distribución: El valor típico del volumen central de distribución (Vc) era de 2,73 litros y 3,28 litros en las mujeres y los hombres, respectivamente, el cual se halla dentro del intervalo de valores descrito para los anticuerpos IgG y otros anticuerpos monoclonales. El valor típico del volumen periférico de distribución (Vp) era de 1,69 litros y 2,35
litros en las mujeres y los hombres, respectivamente, cuando el bevacizumab se coadministraba con antineoplásicos. Tras la corrección por el peso corporal, los sujetos masculinos tenían un Vc mayor (20%) que los de sexo femenino. Metabolismo: La evaluación del metabolismo del bevacizumab en el conejo tras una dosis i.v. única de 125I- bevacizumab mostraba un perfil metabólico similar al esperado para una molécula de IgG nativa sin fijación al VEGF. El metabolismo y la eliminación del bevacizumab son similares a los de la IgG endógena, es decir, sufren sobre todo un catabolismo proteolítico en todo el organismo, incluidas las células endoteliales, y no se basan fundamentalmente en la eliminación por vía renal y hepática. La unión de la IgG a los receptores FcRn tiene como consecuencia la protección frente al metabolismo celular y una semivida terminal larga. Eliminación: La farmacocinética del bevacizumab es lineal en dosis de 1,5 a 10 mg/kg/semana. El valor del aclaramiento es en promedio de 0,188 y 0,220 l/día en los pacientes de sexo femenino y masculino, respectivamente. Tras la corrección por el peso corporal, los pacientes masculinos presentaban un aclaramiento del bevacizumab mayor (+ 17%) que los femeninos. Según el modelo bicompartimental, la semivida de eliminación es de 18 días para un paciente femenino típico y de 20 para un paciente masculino típico. Farmacocinética en poblaciones especiales: Se realizó un análisis de farmacocinética poblacional del bevacizumab para evaluar los efectos de las características demográficas. Los resultados no revelaron ninguna diferencia significativa en la farmacocinética del bevacizumab en relación con la edad. Niños y adolescentes: La farmacocinética del bevacizumab se ha estudiado en un número reducido de pacientes pediátricos. Los datos farmacocinéticos obtenidos sugieren un volumen de distribución y un aclaramiento del bevacizumab comparables a los registrados en adultos con tumores sólidos. Insuficiencia renal: No se han realizado estudios de la farmacocinética del bevacizumab en pacientes con insuficiencia renal, toda vez que los riñones no son un órgano importante en el metabolismo y la excreción del bevacizumab. Insuficiencia hepática: No se han realizado estudios de la farmacocinética del bevacizumab en pacientes con insuficiencia hepática, toda vez que el hígado no es un órgano importante en el metabolismo y la excreción del bevacizumab. Datos preclínicos sobre seguridad: Carcinogenicidad: No se han realizado estudios para evaluar el potencial carcinógeno de Avastin. Mutagenicidad: No se han realizado estudios para evaluar el potencial mutágeno de Avastin. Trastornos de la fecundidad: No se han realizado estudios específicos en animales para evaluar los efectos de Avastin en la fecundidad. En estudios de toxicidad de dosis múltiples en macacos de Java (Macaca fascicularis) no se observó ningún efecto adverso en los órganos de reproducción masculinos. La inhibición de la función ovárica se caracterizó por un descenso del peso ovárico u uterino y del número de cuerpos lúteos, una reducción de la proliferación endométrica y una inhibición de la maduración folicular en los macacos de Java tratados con Avastin durante 13 o 26 semanas. Las dosis asociadas con este efecto eran ≥ 4 veces superiores a la dosis terapéutica humana o estaban ≥ 2 veces por encima de la exposición esperada en el ser humano, de acuerdo con las concentraciones séricas promedio en las monas. En el conejo, la administración de 50 mg/kg de Avastin se tradujo en descensos significativos del peso ovárico. Tanto en los monos como en los conejos, los resultados revertieron tras la suspensión del tratamiento. Es probable que la inhibición de la angiogénesis tras la administración de Avastin tenga un efecto adverso en la fecundidad femenina. Teratogenicidad: Avastin es embriotóxico y teratógeno en el conejo. Los efectos observados consistían en disminución del peso corporal materno y fetal, incremento del número de resorciones fetales y aumento de la incidencia de alteraciones fetales específicas macroscópicas y esqueléticas. Con todas las dosis ensayadas de 10 a 100 mg/kg se observaron resultados fetales adversos. Otros efectos: Desarrollo epifisario: Avastin se asoció con displasia epifisaria en estudios de hasta 26 semanas de duración en macacos de Java. La displasia epifisaria se caracterizaba principalmente por engrosamiento del cartílago de la placa epifisaria, formación de placa ósea subcondral e inhibición de la invasión vascular de la placa epifisaria. Este efecto se produjo con dosis ≥ 0,8 veces superiores a la dosis terapéutica humana y niveles de exposición ligeramente inferiores a la exposición clínica esperada en el ser humano, de acuerdo con las concentraciones séricas promedio. Hay que destacar, sin embargo, que la displasia epifisaria se produjo solamente en animales en crecimiento activo con placas epifisarias abiertas. Dado que Avastin muy probablemente se administrará a pacientes adultos con placas epifisarias cerradas, no es de temer que se produzca displasia epifisaria en la población clínica. Cicatrización de heridas: Se estudiaron en el conejo los efectos de Avastin en la cicatrización circular. La reepitelización de la herida experimentó un retardo en los conejos tras cinco dosis de Avastin (de 2 a 50 mg/kg) a lo largo de un período de dos semanas. Se observó una tendencia hacia una relación dependiente de la dosis. La magnitud del efecto en la cicatrización fue similar al registrado tras la administración de corticosteroides. Una vez suspendido el tratamiento con 2 o 10 mg/kg de Avastin, las heridas se cerraron por completo. La dosis más baja, 2 mg/mg, era equivalente aproximadamente a la dosis clínica propuesta. También se estudió en el conejo un modelo de cicatrización lineal más sensible. Tres dosis de Avastin de entre 0,5 y 2 mg/kg redujeron la fuerza tensil de las heridas en función de la dosis y significativamente, lo que concordaba con una cicatrización retardada. La dosis baja de 0,5 mg/mg era 5 veces menor que la dosis clínica propuesta. Dados los efectos observados en la cicatrización en el conejo con dosis menores que la dosis clínica propuesta, deberá tenerse en cuenta la capacidad de Avastin para influir adversamente en la cicatrización en el ser humano. En el macaco de Java, los efectos del Avastin en la cicatrización de una incisión lineal variaban en alto grado y no era evidente una relación entre la dosis y la respuesta. Función renal: En macacos de Java normales tratados una o dos veces por semana por espacio de hasta 26 semanas, Avastin no tenía ningún efecto mensurable en la función renal, y tampoco se observó acumulación renal en el conejo tras la administración de dos dosis de hasta 100 mg/kg (aproximadamente 80 veces la dosis clínica propuesta). Estudios de toxicidad en el conejo con aplicación de modelos de disfunción renal pusieron de manifiesto que Avastin no agudizaba la lesión glomerular renal inducida por albúmina sérica bovina o el daño tubular renal inducido por cisplatino. Albúmina: En macacos de Java machos, Avastin administrado en dosis de 10 mg/kg dos veces por semana o de 50 mg/kg una vez por semana durante 26 semanas se asoció con una disminución estadísticamente significativa de la albúmina y del cociente albúmina/globulina y un aumento de la globulina. Estos efectos revertieron una vez terminada la exposición. Dado que los parámetros se mantuvieron dentro del intervalo de valores normal utilizado como referencia para estas variables, los cambios mencionados no se consideraron clínicamente significativos. Hipertensión arterial: En macacos de Java, Avastin en dosis de hasta 50 mg/kg dos veces por semana no afectó a la tensión arterial. Hemostasis: En estudios preclínicos de toxicología de hasta 26 semanas de duración en macacos de Java no se observaron cambios en los parámetros hematológicos o de la coagulación, incluidos el recuento plaquetario, el tiempo de protrombina y el tiempo parcial de tromboplastina activada. Un modelo de hemostasis en el conejo, utilizado para estudiar el efecto del Avastin en la formación de trombos, no reveló diferencias en la velocidad de formación del coágulo u otros parámetros hematológicos en comparación con la administración de los excipientes de Avastin.
Indicaciones.
Carcinoma colorrectal metastásico (CCRm): Avastin en combinación con quimioterapia basada en fluoropirimidinas está indicado para el tratamiento del carcinoma metastásico de colon o recto. Carcinoma de mama localmente recurrente o metastásico (CMm): Avastin en combinación con Paclitaxel está indicado para el tratamiento de primera línea del carcinoma de mama localmente recurrente o metastásico. Carcinoma pulmonar no microcítico (CPNM) avanzado, metastásico o recurrente: Avastin agregado a quimioterapia basada en platino está indicado para el tratamiento de primera línea del CPNM no escamoso avanzado, metastásico o recurrente e irresecable. Carcinoma de células renales avanzado y/o metastásico (CRm): Avastin en combinación con interferón (IFN) alfa-2a está indicado para el tratamiento de primera línea del carcinoma de células renales avanzado y/o metastásico. Gliomas malignos (grado IV de la OMS): glioblastoma: Avastin, en monoterapia, está indicado para el tratamiento de los pacientes con glioblastoma en recidiva o progresión de la enfermedad. Cáncer epitelial de ovario, cáncer de las trompas de Falopio y cáncer peritoneal primario: Avastin en combinación con carboplatino y paclitaxel está indicado para el tratamiento de primera línea del cáncer epitelial de ovario, el cáncer de las trompas de Falopio y el cáncer peritoneal primario. Avastin en combinación con carboplatino y gemcitabina está indicado para el tratamiento del cáncer epitelial de ovario, el cáncer de las trompas de Falopio y el cáncer peritoneal primario recidivantes y sensibles al platino.
Dosificación.
Instrucciones generales: La preparación de Avastin debe realizarla asépticamente un profesional médico o paramédico (ver Instrucciones especiales de uso, manipulación y eliminación). La dosis inicial de Avastin debe administrarse en infusión i.v. de 90 minutos. Si la primera infusión se tolera bien, la segunda puede administrarse en 60 minutos. Si la infusión de 60 minutos se tolera bien, todas las infusiones siguientes pueden administrarse en 30 minutos. No se recomienda reducir la dosis de Avastin en presencia de acontecimientos adversos. Si es preciso, Avastin debe suspenderse definitiva o temporalmente como se describe en Advertencias. Avastin no está formulado para uso intravítreo (ver Advertencias). Carcinoma colorrectal metastásico (CCRm): La dosis recomendada de Avastin, administrada en infusión i.v., es la siguiente: Tratamiento de primera línea: 5 mg/kg una vez cada 2 semanas o 7,5 mg/kg una vez cada 3 semanas. Tratamiento de segunda línea: 5mg/kg o 10 mg/kg una vez cada 2 semanas o 7,5 mg/kg o 15 mg/kg una vez cada 3 semanas. Se recomienda continuar el tratamiento con Avastin hasta la progresión de la enfermedad subyacente. Los pacientes previamente tratados con Avastin pueden proseguir el tratamiento con Avastin tras la primera progresión (ver estudio ML18147). Carcinoma de mama localmente recurrente o metastásico (CMm): La dosis recomendada de Avastin es de 10 mg/kg una vez cada 2 semanas o 15 mg/kg una vez cada 3 semanas, en infusión i.v. Se recomienda continuar el tratamiento con Avastin hasta la progresión de la enfermedad subyacente. Carcinoma pulmonar no microcítico (CPNM) avanzado, metastásico o recurrente: Avastin debe administrarse agregado a quimioterapia basada en platino hasta 6 ciclos, continuando con Avastin en monoterapia hasta la progresión de la enfermedad. La dosis recomendada de Avastin en combinación con quimioterapia basada en cisplatino es de 7,5 mg/kg una vez cada 3 semanas, en infusión i.v. La dosis recomendada de Avastin en combinación con quimioterapia basada en carboplatino es de 15 mg/kg una vez cada 3 semanas, en infusión i.v. Carcinoma de células renales avanzado y/o metastásico (CRm): La dosis recomendada de Avastin es de 10 mg/kg una vez cada 2 semanas, en infusión i.v. Se recomienda continuar el tratamiento con Avastin hasta la progresión de la enfermedad subyacente. Gliomas malignos (grado IV de la OMS): glioblastoma: La dosis recomendada de Avastin es de 10 mg/kg una vez cada 2 semanas o 15 mg/kg una vez cada 3 semanas, en infusión i.v. Se recomienda continuar el tratamiento con Avastin hasta la progresión de la enfermedad subyacente. Cáncer epitelial de ovario, cáncer de las trompas de Falopio y cáncer peritoneal primario: La dosis recomendada de Avastin es de 15 mg/kg una vez cada 3 semanas, en infusión i.v. Tratamiento de primera línea:Avastin debe administrarse agregado a carboplatino y paclitaxel hasta seis ciclos de tratamiento, seguido del uso continuo de Avastin en monoterapia durante 15 meses o hasta la progresión de la enfermedad, lo que sea antes el caso. Tratamiento de la enfermedad recidivante: Avastin se administra en combinación con carboplatino y gemcitabina durante 6 ciclos y hasta 10 ciclos, siguiendo después con el uso continuado de Avastin en monoterapia hasta la progresión de la enfermedad. Pautas posológicas especiales: Niños y adolescentes: No se han estudiado la seguridad y la eficacia de Avastin en niños y adolescentes. Ancianos: No es preciso ajustar la dosis en los ancianos. Insuficiencia renal: No se han estudiado la seguridad y la eficacia de Avastin en pacientes con insuficiencia renal. Insuficiencia hepática: No se han estudiado la seguridad y la eficacia de Avastin en pacientes con insuficiencia hepática.
Contraindicaciones.
Avastin está contraindicado en pacientes con hipersensibilidad conocida a: cualquier componente del producto; productos obtenidos en células ováricas de hámster chino u otros anticuerpos recombinantes humanos o humanizados.
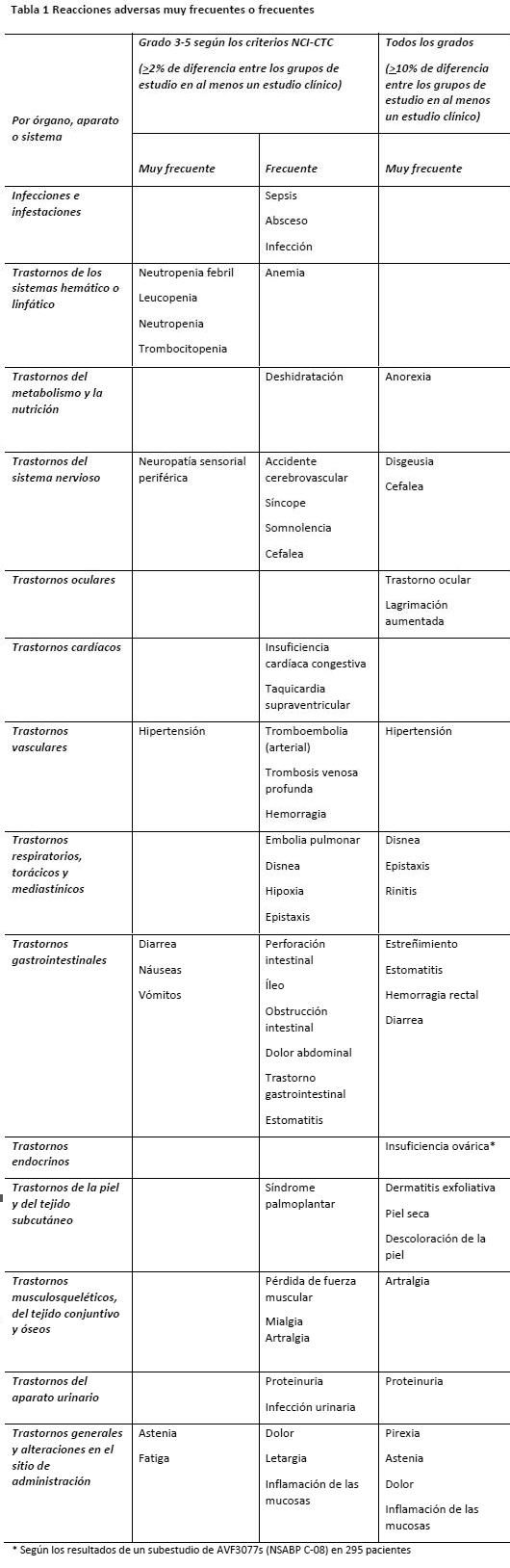
Reacciones adversas.
Ensayos clínicos: Se han realizado estudios clínicos en pacientes con diversas neoplasias malignas tratados con Avastin predominantemente en combinación con quimioterapia. En el presente apartado se presenta el perfil de seguridad de una población clínica de más de 4.500 pacientes. Acerca de la experiencia adquirida tras la comercialización, v. Experiencia tras la comercialización. En Ensayos clínicos/ Eficacia se muestran detallados los principales estudios, con el diseño y los resultados fundamentales relativos a la eficacia. Las reacciones adversas más graves fueron las siguientes: Perforación gastrointestinal (ver Advertencias). Hemorragia, incluida hemorragia pulmonar/hemoptisis, más frecuente en los pacientes con CPNM (ver Advertencias). Tromboembolia arterial (ver Advertencias). Los análisis de los datos de seguridad clínica apuntan a que la hipertensión y la proteinuria en el tratamiento con Avastin probablemente dependen de la dosis. Considerando todos los estudios clínicos, las reacciones adversas más frecuentes en los pacientes tratados con Avastin fueron hipertensión, fatiga o astenia, diarrea y dolor abdominal. La Tabla 1 recoge las reacciones adversas asociadas al uso de Avastin en combinación con diversos regímenes quimioterápicos en múltiples indicaciones. Estas reacciones se produjeron con una diferencia frente al grupo de control de al menos un 2% (reacciones de grados 3-5 según los criterios NCI-CTC) o un 10% (reacciones de grados 1-5 según los criterios NCI-CTC) en al menos uno de los estudios clínicos principales. Las reacciones adversas enumeradas en esta tabla corresponden a las categorías "muy frecuente" (≥ 10%) y "frecuente" (≥ 1% - < 10%). Las reacciones adversas se han categorizado en esta tabla de acuerdo con la incidencia más alta registrada en cualquiera de los estudios clínicos principales. Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden decreciente de gravedad. Algunas de las reacciones adversas son habituales en la quimioterapia (por ejemplo: eritrodisestesia palmoplantar con capecitabina o neuropatía sensorial periférica con paclitaxel u oxaliplatino); ahora bien, no cabe excluir la agudización durante el tratamiento con Avastin.
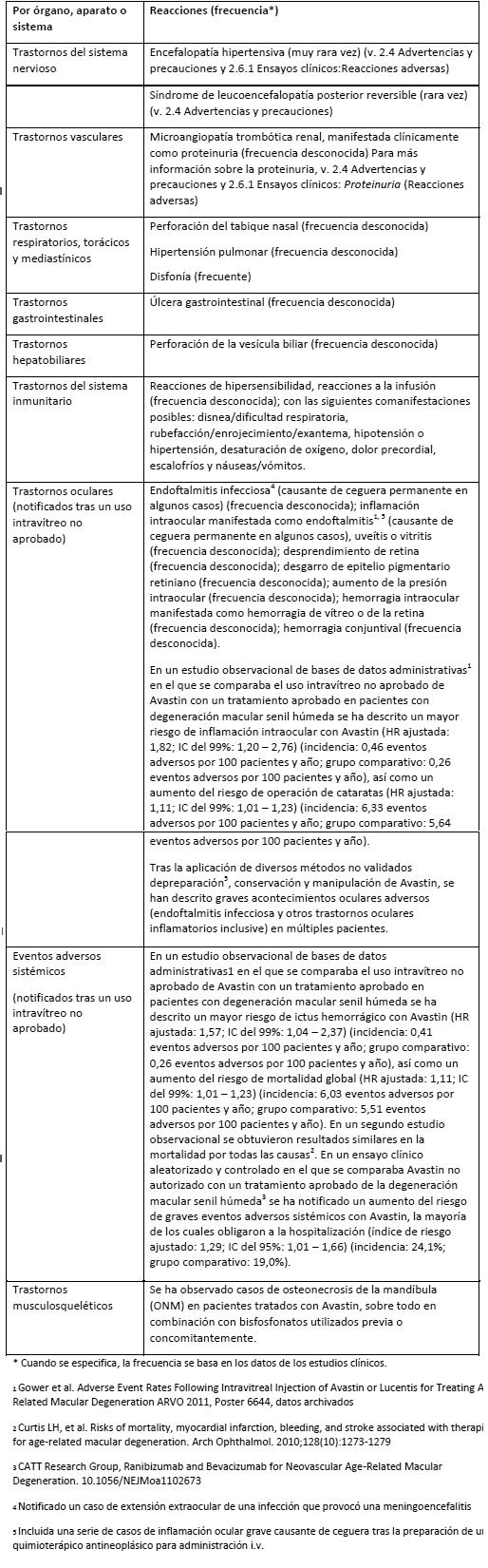
Más información sobre reacciones adversas graves seleccionadas: Entre los pacientes tratados con Avastin se han observado las reacciones adversas siguientes, notificadas de acuerdo con los criterios NCI-CTC (Criterios comunes de toxicidad del Instituto Nacional del Cáncer de Canadá): Perforación gastrointestinal (ver Advertencias y precauciones generales): Se ha asociado Avastin con casos graves de perforación gastrointestinal. En los estudios clínicos se ha notificado perforación gastrointestinal con una incidencia inferior al 1% en pacientes con carcinoma de mama metastásico o CPNM no escamoso, hasta el 2% en pacientes con carcinoma de células renales metastásico o con cáncer de ovario en tratamiento de primera línea y hasta el 2,7% (fistula y absceso gastrointestinal inclusive) en pacientes con carcinoma colorrectal metastásico. Casos de perforación gastrointestinal también se han observado en pacientes con glioblastoma en recidiva. Desenlace letal se ha notificado en aproximadamente un tercio de los casos graves de perforación gastrointestinal, lo que representa el 0,2-1% de todos los pacientes tratados con Avastin. La presentación de estos acontecimientos adversos difería en el tipo y la intensidad: desde la observación de gas libre en una radiografía simple de abdomen, que se resolvió sin tratamiento, hasta una perforación intestinal con absceso abdominal y desenlace letal. En algunos casos había inflamación intraabdominal subyacente por enfermedad ulcerosa gástrica, necrosis tumoral, diverticulitis o colitis asociada a quimioterapia. Una relación causal entre el proceso inflamatorio intraabdominal o la perforación gástrica y Avastin no se ha establecido. Fístula (ver Advertencias): Se ha asociado Avastin a casos graves de fístula, en ocasiones con un desenlace fatal. En los estudios clínicos con Avastin se ha notificado fístula gastrointestinal con una incidencia de hasta el 2% en pacientes con carcinoma colorrectal metastásico, pero también con una frecuencia menor en pacientes con otros tipos de cáncer. En casos poco frecuentes (≥ 0,1% - < 1%) se han descrito otros tipos de fístulas en zonas corporales distintas al tubo digestivo (por ejemplo: fístula broncopleural, urogenital o biliar) en varias otras indicaciones. Fístulas se han notificado también tras la comercialización. Los momentos de aparición durante el tratamiento variaban entre una semana y más de un año tras el comienzo de la administración de Avastin, pero en la mayoría de los casos se hallaban dentro del primer semestre de tratamiento. Hemorragia: En los estudios clínicos de todas las indicaciones, la incidencia global de hemorragia de grados 3-5 según los criterios NCI-CTC fue del 0,4-5% en los pacientes tratados con Avastin frente al 0-2,9% en los del grupo de control con quimioterapia. Los episodios hemorrágicos observados en los estudios clínicos con Avastin consistieron principalmente en hemorragia asociada al tumor (ver más abajo) y hemorragia mucocutánea menor (por ejemplo: epistaxis). Hemorragia asociada al tumor: Hemorragia pulmonar/hemoptisis importante o masiva se ha observado primordialmente en los estudios realizados en pacientes con CPNM. Posibles factores de riesgo son: citología escamosa, tratamiento con antirreumáticos/antiinflamatorios, tratamiento con anticoagulantes, radioterapia previa, tratamiento con Avastin, antecedentes de aterosclerosis, tumor en el sistema nervioso central y cavitación tumoral antes del tratamiento o durante el mismo. Las únicas variables que presentaban una correlación estadísticamente significativa con la hemorragia eran el tratamiento con Avastin y la citología escamosa. De los estudios siguientes se excluyó a los pacientes con CPNM de citología escamosa conocida o de tipo celular mixto con histología predominantemente escamosa, pero sí se incluyó a los que tenían una histología tumoral desconocida. En los pacientes con CPNM sin histología predominantemente escamosa se observaron acontecimientos de todos los grados con una frecuencia de hasta el 9% si habían recibido Avastin + quimioterapia y del 5% si habían recibido quimioterapia sola. Acontecimientos de grados 3-5 se han registrado en hasta un 2,3% de los pacientes tratados con Avastin + quimioterapia frente a < 1% de los que recibieron quimioterapia sola. Hemorragia pulmonar/ hemoptisis importante o masiva puede presentarse repentinamente; hasta dos tercios de los casos de hemorragia pulmonar grave tuvieron un desenlace fatal (ver Advertencias). En los pacientes con carcinoma colorrectal se han descrito hemorragias gastrointestinales, incluidas hemorragia rectal y melena, y se han valorado como hemorragias asociadas al tumor. También se han observado hemorragias asociadas al tumor en otros tipos de tumor y otras localizaciones, incluido un caso de hemorragia del SNC entre los pacientes con metástasis del SNC y los pacientes con glioblastoma. La incidencia de hemorragia del SNC en pacientes con metástasis del SNC tratados con bevacizumab no se ha evaluado prospectivamente en estudios clínicos aleatorizados. En un análisis exploratorio retrospectivo de los datos de 13 estudios clínicos aleatorizados finalizados en pacientes con diversos tipos de tumor, 3 de 91 (3,3%) con metástasis cerebrales sufrieron hemorragia del SNC (grado 4 en todos los casos) cuando recibieron bevacizumab frente a 1 (grado 5) de 96 (1%) no tratados con bevacizumab. En dos estudios siguientes en pacientes con metástasis cerebrales tratadas (unos 800 pacientes) se notificó un caso de hemorragia del SNC de grado 2. Los pacientes con glioblastoma en recidiva pueden sufrir hemorragia intracraneal. En el estudio AVF3708g se notificó hemorragia del SNC en el 2,4% (2/84) de los pacientes del grupo de Avastin en monoterapia (grado 1) y en el 3,8% (3/79) de los tratados con Avastin e irinotecán (grados 1, 2 y 4). Considerando todos los estudios clínicos con Avastin, la tasa de hemorragias mucocutáneas ha sido de hasta el 50% en los pacientes tratados con Avastin. Por lo general, consistieron en epistaxis de grado 1 según los criterios NCI-CTC, con una duración inferior a 5 minutos, resuelta sin intervención médica y que no obligó a cambiar el régimen terapéutico de Avastin. De los datos clínicos sobre seguridad se infiere que la incidencia de hemorragias mucocutáneas menores (por ejemplo: epistaxis) puede depender de la dosis. También ha habido episodios menos frecuentes de hemorragia mucocutánea menor en otras localizaciones, como hemorragia gingival y hemorragia vaginal. Hipertensión (ver Advertencias): Se ha observado un aumento de la incidencia de hipertensión (todos los grados) de hasta el 42,1% en los pacientes tratados con Avastin frente hasta un 14% en el grupo de comparación. En los estudios clínicos de todas las indicaciones, la incidencia global de hipertensión de grados 3 y 4 según los criterios NCI-CTC osciló entre el 0,4% y el 17,9% en los pacientes tratados con Avastin. Hipertensión de grado 4 (crisis hipertensiva) se produjo en hasta el 1,0% de los pacientes tratados con Avastin y hasta el 0,2% de los que recibieron quimioterapia sola. En general, la hipertensión se controló adecuadamente con antihipertensivos orales como inhibidores de la enzima de conversión de la angiotensina, diuréticos e inhibidores de los canales del calcio. En raras ocasiones condujo a la suspensión del tratamiento con Avastin o la hospitalización. Encefalopatía hipertensiva se ha notificado en muy raras ocasiones, algunas de ellas letales (ver también Advertencias). El riesgo de hipertensión asociada a Avastin no guardaba relación con las características basales del paciente, enfermedades subyacentes o tratamientos concomitantes. Síndrome de leucoencefalopatía posterior reversible (SLPR) (ver Advertencias): En un estudio clínico se han notificado dos casos confirmados (0,8%) de SLPR. Los síntomas suelen desaparecer o mejorar en pocos días, pero algunos pacientes han experimentado secuelas neurológicas. Tromboembolias: Tromboembolia arterial: Entre los pacientes tratados con Avastin de todas las indicaciones se observó un incremento de la incidencia de episodios tromboembólicos arteriales (accidentes cerebrovasculares, infarto agudo de miocardio, accidentes isquémicos transitorios y otros episodios tromboembólicos arteriales). En los estudios clínicos, la incidencia global fue de hasta el 3,8% en los grupos de Avastin frente hasta el 1,7% en los grupos de control con quimioterapia. Desenlace letal se notificó en el 0,8% de los pacientes tratados con Avastin en combinación con quimioterapia frente al 0,5% en los grupos de quimioterapia sola. Accidentes cerebrovasculares (ataques isquémicos transitorios) se notificaron en hasta el 2,3% de los pacientes que habían recibido Avastin frente al 0,5% en el grupo de control: infarto de miocardio se registró en el 1,4% de los pacientes tratados con Avastin frente al 0,7% en el grupo de control. En un estudio clínico, AVF2192g, se incluyó a pacientes con carcinoma colorrectal metastásico que no eran candidatos para el tratamiento con irinotecán. En este estudio, episodios tromboembólicos se registraron en el 11% (11/100) de los pacientes tratados con Avastin frente al 5,8% (6/14) en el grupo de control con quimioterapia. Tromboembolia venosa: En los estudios clínicos de todas las indicaciones, la incidencia global de episodios de tromboembolia venosa fue del 2,8-17,3% en los grupos de Avastin frente al 3,2-15,6% en los de control con quimioterapia. Los episodios de tromboembolia venosa consistieron en trombosis y embolia pulmonar. Episodios de tromboembolia venosa de grados 3-5 se han descrito en hasta un 7,8% de los pacientes tratados con quimioterapia + bevacizumab frente hasta un 4,9% de los que recibieron quimioterapia sola. Los pacientes que han sufrido un episodio de tromboembolia venosa pueden correr un riesgo mayor de recidiva si reciben Avastin en combinación con quimioterapia en lugar de quimioterapia sola. Insuficiencia cardíaca congestiva: En los estudios clínicos de Avastin se ha observado insuficiencia cardíaca congestiva (ICC) en todas las indicaciones oncológicas hasta ahora, pero predominantemente en las pacientes con carcinoma de mama metastásico. En cuatro estudios de fase III (AVF2119g, E2100, BO17708 y AVF3694g) en pacientes con carcinoma de mama metastásico se describió ICC de grado 3 o superior en hasta el 3,5% de las pacientes tratadas con Avastin en combinación con quimioterapia en comparación hasta un 0,9% en los grupos de control. En cuatro pacientes del estudio AVF3694g tratadas con antraciclinas concomitantemente con bevacizumab se registraron incidencias de ICC de grado 3 o superior en los grupos de bevacizumab y de control similares a las observadas en otros estudios del carcinoma de mama metastásico: 2,9% en el grupo de antraciclina + bevacizumab y 0% en el grupo de antraciclina + placebo. Además, las incidencias de ICC de todos los grados en el estudio AVF3694g fueron similares en los grupos de antraciclina + Avastin (6,2%) y de antraciclina + placebo (6,0%). En la mayoría de las pacientes que desarrollaron ICC durante los estudios de CMm se observó una mejoría de los síntomas y/o de la función ventricular izquierda tras el tratamiento médico correspondiente. En la mayoría de los estudios clínicos con Avastin se excluyó a los pacientes con ICC preexistente de clases II-IV de la NYHA, por lo que no hay información disponible sobre el riesgo de ICC en esta población. La exposición anterior a antraciclinas o una radioterapia anterior de la pared torácica pueden constituir factores de riesgo posibles de ICC (ver Advertencias). En un estudio clínico en pacientes con linfoma difuso de células B grandes se ha observado un aumento de la incidencia de ICC al administrar bevacizumab con una dosis acumulativa de doxorrubicina superior a 300 mg/m2. En este estudio clínico de fase III se comparaba rituximab/ciclofosfamida/doxorrubicina/vincristina/prednisona (R-CHOP) + bevacizumab con R- CHOP sin bevacizumab. Aunque la incidencia de ICC superó en ambos grupos la observada previamente con doxorubicina, la tasa fue más alta en el grupo de R-CHOP + bevacizumab. Cicatrización de heridas (ver Advertencias): Dado que Avastin puede afectar negativamente a la cicatrización de las heridas, se excluyó de los estudios clínicos de fase III a los pacientes sometidos a cirugía mayor dentro de los 28 días previos al comienzo del tratamiento con Avastin. En ninguno de los estudios clínicos del CCRm aumentó el riesgo de hemorragia postoperatoria o complicaciones de la cicatrización en los pacientes sometidos a cirugía mayor entre 28 y 60 días antes de comenzar el tratamiento con Avastin. Se observó un incremento de la incidencia de hemorragia postoperatoria o complicaciones de la cicatrización de la herida dentro de los 60 días siguientes a una intervención quirúrgica mayor cuando el paciente estaba recibiendo Avastin en el momento de la operación. La incidencia osciló entre el 10% (4/40) y el 20% (3/15). En estudios del carcinoma de mama localmente recurrente y metastásico se observaron complicaciones de la cicatrización de la herida de grados 3-5 en hasta un 1,1% de las pacientes tratadas con Avastin frente hasta un 0,9% de las pacientes en los grupos de control. En el estudio de pacientes con glioblastoma en recidiva (estudio AVF3708g), la incidencia de complicaciones postoperatorias de la cicatrización de la herida (dehiscencia de la herida en el sitio de craneotomía y fuga de líquido cefalorraquídeo) fue del 3,6% en los pacientes tratados con Avastin en monoterapia y del 1,3% en los que recibieron Avastin + irinotecán. Proteinuria (ver Advertencias): En los estudios clínicos se ha descrito proteinuria con una tasa de entre el 0,7% y el 38% de los pacientes tratados con Avastin. El grado de proteinuria iba de clínicamente asintomática, transitoria, microalbuminuria a síndrome nefrótico. Proteinuria de grado 3 se observó en < 8,1% de los pacientes tratados. Proteinuria de grado 4 (síndrome nefrótico) se detectó en hasta el 1,4% de los pacientes tratados. La proteinuria observada en los estudios clínicos con Avastin no se asoció a trastornos renales y rara vez obligó a la suspensión permanente del tratamiento con Avastin. Los pacientes con antecedentes de hipertensión pueden correr un mayor riesgo de desarrollar proteinuria si reciben Avastin. Existen indicios de que la proteinuria de grado 1 podría estar relacionada con la dosis de Avastin. Se recomienda realizar una prueba de proteinuria antes de empezar el tratamiento con Avastin. En la mayoría de los estudios clínicos, ante una concentración de proteínas en la orina > 2 g/24 h se retiró Avastin hasta la recuperación a niveles 2 g/24 h. Hipersensibilidad, reacciones a la infusión (ver Advertencias y Experiencia tras la comercialización: Reacciones adversas): En algunos estudios clínicos, las reacciones anafilácticas y anafilactoides se notificaron con mayor frecuencia en los pacientes tratados con Avastin en combinación con quimioterapia que en los que recibieron quimioterapia sola. La incidencia de estas reacciones fue frecuente en algunos estudios clínicos con Avastin (hasta un 5% en los pacientes tratados con bevacizumab). Insuficiencia ovárica / Fecundidad (ver Advertencias y Embarazo): Se ha evaluado la incidencia de nuevos casos de insuficiencia ovárica, definida como amenorrea durante 3 o más meses, concentración de FSH ≥ 30 mUI/ml y test de embarazo con determinación de b-HCG en sangre negativo. Entre las pacientes tratadas con bevacizumab se han descrito con más frecuencia nuevos casos de insuficiencia ovárica. Tras la retirada del tratamiento con bevacizumab, la función ovárica se recuperó en la mayoría de las mujeres. Se desconocen los efectos a largo plazo en la fecundidad del tratamiento con bevacizumab. Ancianos: En los ensayos clínicos aleatorizados, el riesgo de padecer episodios tromboembólicos arteriales (accidentes cerebrovasculares, accidentes isquémicos transitorios, infarto agudo de miocardio) durante el tratamiento con Avastin fue mayor en los pacientes de 65 o más años (ver Advertencias y Ensayos clínicos: Tromboembolias). Otras reacciones con una frecuencia elevada observadas en pacientes de más de 65 años fueron leucocitopenia y trombocitopenia de grados 3-4, así como neutrocitopenia de todos los grados, diarrea, náuseas, cefalea y fatiga. En los pacientes ancianos ( > 65 años) tratados con Avastin no se observó ningún aumento de la incidencia de otras reacciones (perforación gastrointestinal, complicaciones de la cicatrización de heridas, hipertensión arterial, proteinuria, insuficiencia cardíaca congestiva y hemorragia) en comparación con los de ≤65 años tratados con este medicamento. Alteraciones analíticas: El tratamiento con Avastin puede acompañarse de un descenso de la cifra de neutrófilos y leucocitos y de proteinuria. En los estudios clínicos se observaron las siguientes alteraciones de laboratorio de grados 3 y 4 con una incidencia mayor (≥2%) en los pacientes tratados con Avastin que en los de los grupos de control: hiperglucemia, disminución de la hemoglobina, hiperpotasemia, hiponatremia, descenso de la cifra de leucocitos, aumento del tiempo de protrombina y la razón normalizada. Experiencia tras la comercialización:
Advertencias.
Perforación gastrointestinal: El tratamiento con Avastin puede elevar el riesgo de perforación gastrointestinal (ver Ensayos clínicos) y de la vesícula biliar (ver Experiencia tras la comercialización). El tratamiento con Avastin debe suspenderse definitivamente en caso de perforación gastrointestinal. Fístula (ver Ensayos clínicos): El tratamiento con Avastin puede elevar el riesgo de fístula (ver Ensayos clínicos). En pacientes con fístula traqueoesofágica o cualquier tipo de fístula de grado 4 debe suspenderse definitivamente la administración de Avastin. Es escasa la información existente sobre el uso continuado de Avastin en pacientes con otras fístulas. En caso de fístula interna no localizada en el tubo digestivo, se considerará la idoneidad de suspender Avastin. Hemorragia (ver Ensayos clínicos): En los pacientes tratados con Avastin está incrementado el riesgo de hemorragia, particularmente de hemorragia asociada al tumor (ver Ensayos clínicos: Hemorragia). La administración de Avastin debe suspenderse definitivamente en los pacientes con hemorragia de grados 3 o 4 durante el tratamiento. Pacientes con metástasis del sistema nervioso central (SNC), determinadas por técnicas de imágenes o por signos y síntomas, fueron excluidos sistemáticamente de los estudios clínicos con Avastin. Por consiguiente, el riesgo de hemorragia del SNC en tales pacientes no se ha evaluado prospectivamente en estudios clínicos aleatorizados (ver Ensayos clínicos: Hemorragia). Se vigilará en los pacientes la presencia de signos y síntomas de hemorragia del SNC y se suspenderá la administración de Avastin en caso de hemorragia intracraneal. No hay datos sobre el perfil de toxicidad de Avastin en pacientes con diátesis hemorrágica congénita, coagulopatía adquirida o en tratamiento anticoagulante con dosis plenas de una tromboembolia anterior al inicio del tratamiento con Avastin, puesto que tales pacientes fueron excluidos de los estudios clínicos. Por consiguiente, se requiere precaución antes de iniciar el tratamiento con Avastin en tales pacientes. Sin embargo, no parece que en los pacientes que sufren una trombosis venosa durante el tratamiento con Avastin sea mayor el riesgo de hemorragia de grado 3 o superior si reciben dosis plenas de warfarina y Avastin simultáneamente. Infecciones oculares graves tras la preparación de la solución para uso intravítreo no aprobado (ver Experiencia tras la comercialización: Reacciones adversas): Se han descrito casos individuales y series de graves acontecimientos oculares adversos (endoftalmitis infecciosa y otros trastornos oculares inflamatorios inclusive) tras el uso intravítreo no aprobado de Avastin preparado a partir de viales aprobados para la administración intravenosa en pacientes con cáncer. Algunos de estos acontecimientos han causado pérdida visual de diversos grados, incluida la ceguera permanente. Hemorragia pulmonar/ hemoptisis (ver Reacciones adversas): Los pacientes con CPNM tratados con Avastin pueden correr un riesgo de hemorragia pulmonar/hemoptisis grave o, en algunos casos, letal (ver Ensayos clínicos: Hemorragia). Los pacientes con historia reciente de hemorragia pulmonar/hemoptisis ( > 1/2 cucharilla de sangre roja) no deben recibir Avastin. Hipertensión: Entre los pacientes tratados con Avastin se ha observado un aumento de la incidencia de hipertensión. De los datos clínicos sobre seguridad se infiere que la incidencia de la hipertensión probablemente depende de la dosis. La hipertensión preexistente debe controlarse adecuadamente antes de empezar el tratamiento con Avastin. No hay datos sobre el efecto de Avastin en pacientes con hipertensión no controlada en el momento de comenzar el tratamiento con este medicamento. Se recomienda vigilar la tensión arterial durante el tratamiento con Avastin (ver Ensayos clínicos). En la mayoría de los casos, la hipertensión se controló adecuadamente con un tratamiento antihipertensivo estándar ajustado a la situación particular del paciente afectado. El tratamiento con Avastin debe suspenderse definitivamente si una hipertensión clínicamente importante no puede controlarse de modo adecuado con un tratamiento antihipertensivo o si el paciente sufre una crisis hipertensiva o una encefalopatía hipertensiva (ver Ensayos clínicos y Experiencia tras la comercialización). Síndrome de leucoencefalopatía posterior reversible (SLPR): En raras ocasiones se han descrito en pacientes tratados con Avastin signos y síntomas compatibles con el síndrome de leucoencefalopatía posterior reversible (SLPR), un raro trastorno neurológico que se manifiesta clínicamente con los siguientes signos y síntomas (entre otros): convulsiones, cefalea, estado mental alterado, deterioro visual o ceguera cortical, con o sin hipertensión asociada. El diagnóstico de SLPR requiere la confirmación por técnicas de imagen cerebral, preferiblemente la resonancia magnética (RM). En pacientes con SLPR se recomienda el tratamiento de los síntomas específicos, incluido el control de la hipertensión, junto con la retirada de Avastin. Se desconocen los efectos toxicológicos de reiniciar la administración de Avastin en los pacientes que hayan experimentado antes el SLPR (ver Ensayos clínicos y v. Experiencia tras la comercialización). Tromboembolia arterial: En los estudios clínicos, la incidencia de episodios tromboembólicos arteriales (accidentes cerebrovasculares, accidentes isquémicos transitorios e infarto agudo de miocardio) fue superior en los pacientes tratados con Avastin + quimioterapia que en los que recibieron quimioterapia sola. El tratamiento con Avastin debe suspenderse de manera definitiva en los pacientes que presenten algún episodio tromboembólico arterial. Los pacientes tratados con Avasti
n + quimioterapia que tengan más de 65 años o antecedentes de tromboembolia arterial corren un mayor riesgo de sufrir un episodio de tromboembolia arterial mientras reciben Avastin. El tratamiento de tales pacientes con Avastin exige precaución. Tromboembolia venosa (ver Reacciones adversas): Los pacientes tratados con Avastin pueden correr el riesgo de sufrir un episodio de tromboembolia venosa, incluida una embolia pulmonar. Se suspenderá la administración de Avastin en los pacientes con episodios de tromboembolia venosa potencialmente mortales (grado 4), como embolia pulmonar. Si ésta es de grado ≤3, se los vigilará estrechamente. Insuficiencia cardíaca congestiva (ver Reacciones adversas): En los estudios clínicos se han descrito episodios compatibles con insuficiencia cardíaca congestiva (ICC). Las observaciones clínicas iban desde descenso asintomático de la fracción de eyección ventricular izquierda a ICC sintomática, con necesidad de tratamiento u hospitalización. La administración de Avastin a pacientes con una cardiovasculopatía clínicamente importante, por ejemplo una coronariopatía preexistente, o ICC preexistente exige especial precaución. La mayoría de los pacientes que sufrieron ICC presentaban carcinoma de mama metastásico y habían recibido previamente tratamiento con antraciclinas o radioterapia de la pared torácica izquierda o tenían otros factores de riesgo de ICC. En los pacientes del estudio AVF3694g tratados con antraciclinas y que no habían recibido antraciclinas previamente no se elevó la incidencia de ICC de todos los grados en el grupo de antraciclina + bevacizumab en comparación con los que habían recibido antraciclinas solamente. Episodios de ICC de grado 3 o superior fueron algo más frecuentes entre los pacientes tratados con bevacizumab en combinación con quimioterapia que entre los que recibieron quimioterapia sola. Esta observación concuerda con los resultados de otros estudios del carcinoma de mama metastásico sin tratamiento antraciclínico concomitante (ver Ensayos clínicos). Neutrocitopenia: Se ha observado un incremento de las tasas de neutrocitopenia, neutrocitopenia febril e infección con neutrocitopenia grave (incluidos algunos fallecimientos) en los pacientes tratados con ciertos regímenes quimioterápicos mielotóxicos + Avastin en comparación con la quimioterapia sola. Cicatrización de heridas: Avastin puede afectar negativamente al proceso de cicatrización de las heridas. El tratamiento con Avastin no debe iniciarse hasta que hayan transcurrido al menos 28 días desde una intervención de cirugía mayor o hasta que la herida quirúrgica haya cicatrizado por completo. En caso de complicaciones de la cicatrización durante el tratamiento con Avastin, éste debe retirarse temporalmente hasta la plena cicatrización de la herida. La administración de Avastin debe suspenderse de forma transitoria ante una intervención quirúrgica programada (ver Ensayos clínicos). Proteinuria (ver Reacciones adversas): En los estudios clínicos, la incidencia de proteinuria fue mayor en los pacientes tratados con Avastin en combinación con quimioterapia que en los que recibieron quimioterapia sola. Proteinuria de grado 4 (síndrome nefrótico) fue poco frecuente en los pacientes tratados con Avastin. En caso de proteinuria de grado 4, la administración de Avastin debe suspenderse definitivamente. Reacciones de hipersensibilidad, reacciones a la infusión (ver Ensayos clínicos y Experiencia tras la comercialización): Los pacientes pueden sufrir reacciones a la infusión/de hipersensibilidad. Se recomienda observar estrechamente a los pacientes durante la administración de bevacizumab y tras la misma, como corresponde a cualquier infusión de un anticuerpo monoclonal humanizado terapéutico. En caso de que se produzca una reacción, se debe retirar la infusión e instaurar las medidas terapéuticas adecuadas. No se considera necesaria la premedicación sistemática. Insuficiencia ovárica / Fecundidad (ver Embarazo y Ensayos clínicos: Reacciones adversas): Avastin puede alterar la fecundidad femenina. Por tanto, antes de comenzar el tratamiento con Avastin de mujeres con capacidad de procrear deben analizarse con ellas estrategias para preservar la fecundidad. Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios sobre los efectos en la capacidad de conducir y utilizar máquinas. Ahora bien, no hay indicios de que el tratamiento con Avastin dé lugar a un aumento de acontecimientos adversos que pudieran alterar la capacidad para conducir vehículos o utilizar máquinas o bien la capacidad mental.
Interacciones.
Efecto de los antineoplásicos en la farmacocinética del bevacizumab: Los resultados de un análisis de farmacocinética poblacional no han revelado ninguna influencia farmacocinética clínicamente importante de la quimioterapia coadministrada en la farmacocinética de Avastin. No se observó significación estadística ni había diferencias clínicas importantes en el aclaramiento de Avastin en los pacientes que habían recibido Avastin en monoterapia en comparación con los tratados con Avastin en combinación con interferón alfa- 2a u otras quimioterapias (IFL, 5-FU/LV, carboplatino-paclitaxel, capecitabina, doxorrubicina o cisplatino/gemcitabina). Efecto del bevacizumab en la farmacocinética de otros antineoplásicos: Los resultados del estudio de interacciones farmacológicas AVF135g han demostrado que el bevacizumab no ejerce ningún efecto importante en la farmacocinética del irinotecán y de su metabolito activo SN38. Los resultados del estudio NP18587 han demostrado que el bevacizumab no ejerce ningún efecto importante en la farmacocinética de la capecitabina y sus metabolitos ni en la farmacocinética del oxaliplatino de acuerdo con los valores de platino libre y platino total. Los resultados del estudio BO17705 han demostrado que el bevacizumab no ejerce ningún efecto importante en la farmacocinética del IFN alfa-2a. Los resultados del estudio BO17704 han demostrado que el bevacizumab no ejerce ningún efecto importante en la farmacocinética del cisplatino. A causa de la variabilidad entre los pacientes y del reducido tamaño de muestra, los resultados del estudio BO17704 no permiten extraer conclusiones en firme sobre el impacto del bevacizumab sobre la farmacocinética de la gemcitabina. Bevacizumab en combinación con maleato de sunitinib: En dos estudios clínicos del carcinoma de células renales metastásico se notificó anemia hemolítica microangiopática (MAHA) en 7 de 19 pacientes tratados con bevacizumab (10 mg/kg cada dos semanas) en combinación con maleato de sunitinib (50 mg al día). MAHA es un trastorno hemolítico que puede presentarse con fragmentación eritrocitaria, anemia y trombocitopenia. En algunos de estos pacientes se observaron también hipertensión (incluidas crisis hipertensivas), aumento de la creatinina y síntomas neurológicos. Todos estos acontecimientos adversos revirtieron tras la retirada del bevacizumab y el maleato de sunitinib (ver Advertencias: Hipertensión, Proteinuria, SLPR). Radioterapia: No se han estudiado la seguridad y la eficacia del uso concomitante de radioterapia y Avastin. Uso en poblaciones especiales: Embarazo: Se ha demostrado que la angiogénesis tiene una importancia crucial para el desarrollo fetal. La inhibición de la angiogénesis tras la administración de Avastin podría conducir a un resultado adverso del embarazo. No se han realizado estudios adecuados y bien controlados en mujeres embarazadas (ver Teratogenicidad). Las inmunoglobulinas IgG atraviesan la barrera placentaria, y Avastin podría inhibir la angiogénesis en el feto. Por consiguiente, Avastin no debe administrarse durante el embarazo. Se recomienda que las mujeres en edad de procrear adopten medidas anticonceptivas adecuadas durante el tratamiento con Avastin. Por razones farmacocinéticas, se recomiendan medidas anticonceptivas durante un mínimo de 6 meses tras la última dosis de Avastin. Fecundidad (ver Advertencias y Ensayos clínicos: Reacciones adversas): En estudios de seguridad con dosis múltiples en animales se ha observado que el bevacizumab puede tener un efecto adverso en la fecundidad femenina (ver Datos preclínicos sobre seguridad). Un subestudio en 295 mujeres premenopáusicas reveló una incidencia más alta de nuevos casos de insuficiencia ovárica en el grupo del bevacizumab que en el grupo de control. Tras la retirada del tratamiento con bevacizumab, la función ovárica se recuperó en la mayoría de las mujeres. Se desconocen los efectos a largo plazo en la fecundidad del tratamiento con bevacizumab. Lactancia: No se sabe si bevacizumab pasa a la leche materna humana. Considerando que la IgG materna pasa a la leche y que Avastin podría dañar el crecimiento y el desarrollo del recién nacido, se recomendará a las mujeres que suspendan la lactancia durante el tratamiento con Avastin y que no amamanten durante un mínimo de 6 meses tras la última dosis de Avastin. Uso en pediatría: No se han estudiado la seguridad y la eficacia de Avastin en niños y adolescentes. Uso en geriatría: Ver Tromboembolia arterial en Advertencias. Insuficiencia renal: No se han estudiado la seguridad y la eficacia de Avastin en pacientes con insuficiencia renal. Insuficiencia hepática: No se han estudiado la seguridad y la eficacia de Avastin en pacientes con insuficiencia hepática.
Conservación.
Avastin no debe utilizarse después de la fecha de caducidad, indicada con EXP en el envase. Los viales deben conservarse en un refrigerador a 2-8°C. Manténgase el vial en el embalaje externo de cartón para protegerlo de la luz. Evítese congelar los viales. Evítese agitar los viales. Avastin no contiene ningún conservante antimicrobiano. Por ello, es preciso manejar los viales con precaución para asegurar la esterilidad de la solución preparada. Está demostrada la estabilidad química y física tras la primera apertura durante 48 horas, entre 2°C y 30°C, en solución salina al 0,9%. Desde un punto de vista microbiológico, la solución preparada debe utilizarse inmediatamente. Si no se utiliza inmediatamente, la duración y las condiciones de conservación del producto son de la responsabilidad del usuario. Habitualmente, no debería sobrepasar las 24 horas a 2-8°C, salvo que la dilución se haya realizado en condiciones asépticas controladas y validadas. Instrucciones especiales de uso, manipulación y eliminación: La infusión de Avastin no debe administrarse ni mezclarse con soluciones glucosadas (ver más abajo Incompatibilidades). Avastin no debe administrarse en inyección i.v. rápida o bolo i.v. La preparación de Avastin debe realizarla asépticamente un profesional médico o paramédico. Extráigase la cantidad necesaria de bevacizumab y dilúyase con solución salina al 0,9% hasta el volumen de administración requerido. La concentración de la solución de bevacizumab final debe mantenerse entre 1,4 mg/ml y 16,5 mg/ml. Elimínese toda porción no utilizada del vial, ya que este producto no contiene conservantes. Los productos de uso parenteral deben inspeccionarse visualmente antes de su administración para descartar la presencia de partículas o cambios de color. Avastin no está formulado para uso intravítreo. Incompatibilidades: No se ha descrito ninguna incompatibilidad entre Avastin y las bolsas de cloruro de polivinilo o poliolefina. Tras la dilución con solución glucosada (5%) se ha observado un perfil de degradación de Avastin dependiente de la concentración. Eliminación de medicamentos no utilizados/caducados: La emisión de productos farmacéuticos al medio ambiente debe reducirse a un mínimo. Los medicamentos no deben eliminarse a través de las aguas residuales, y su eliminación con los residuos domésticos también debe evitarse. Utilice los sistemas de recogida establecidos si los hay en su localidad.
Sobredosificación.
La dosis más alta ensayada en el ser humano (20 mg/kg cada 2 semanas, por vía i.v.) se asoció con migraña intensa en varios pacientes.
Presentación.
Viales con 400 mg/16 ml: envase con 1. Viales con 100 mg/4ml: envase con 1.

