INVIRASE®
ROCHE
Antivírico, inhibidor de la proteasa (IP) del virus de la inmunodeficiencia humana (VIH); código ATC: J05A E01.
Composición.
Principio activo: mesilato de saquinavir. Cada comprimido recubierto contiene el equivalente de 500 mg de saquinavir. Forma farmacéutica: Comprimidos recubiertos de 500 mg. Vía de administración: Oral. Lista de excipientes: Invirase en comprimidos recubiertos de 500 mg: Núcleo de los comprimidos: celulosa microcristalina, croscarmelosa de sodio, povidona, 38,5 mg de lactosa (monohidrato), estearato de magnesio. Recubrimiento de los comprimidos: hipromelosa, dióxido de titanio (E 171), talco, triacetato de glicerol, óxido de hierro amarillo y rojo (E 172).
Farmacología.
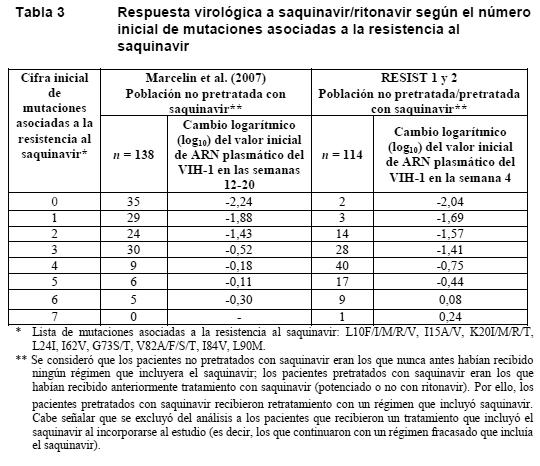
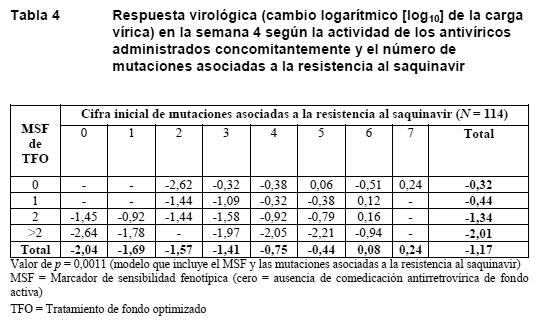
Propiedades farmacodinámicas: Mecanismo de acción: La proteasa del VIH es una enzima esencial para la escisión específica de las poliproteínas víricas gag y gag-pol. Estas poliproteínas víricas contienen un lugar de escisión reconocido únicamente por las proteasas del VIH y otros virus afines. El saquinavir tiene una estructura seudopeptídica que imita la del sitio de escisión del virus. El saquinavir es un inhibidor selectivo y reversible de la proteasa del VIH, que impide la formación de partículas víricas maduras infecciosas. Actividad antivírica in vitro: El saquinavir ha demostrado actividad antivírica contra cepas del VIH-1 tanto de laboratorio como clínicas con valores característicos de CE50 y CE90 dentro del intervalo de 1-10 nM y 5-50 nM, respectivamente, utilizándose líneas de linfocitos T o de linfocitos/monocitos humanos primarios con infección aguda. La actividad antivírica in vitro se observó frente a diversas cepas aisladas del grupo M del VIH-1 no pertenecientes al subtipo B (A, AE, C, D, F, G y H) y frente al VIH-2, con valores de CE50 de 0,3-2,5 nM. En presencia de un 50% de suero humano o de glucoproteína ácida alfa-1 (1 mg/ml), la actividad antivírica del saquinavir descendía en promedio 25 y 14 veces, respectivamente. Resistencia al saquinavir: Resistencia in vitro: Selección de resistencia in vitro del VIH-1 natural (wild-type): Se ha observado que con concentraciones crecientes de saquinavir se desarrollan las mutaciones más frecuentemente notificadas (G48V y L90M), durante el pase in vitro del VIH-1 natural. Virus recombinantes con las mutaciones G48V y L90M presentaban una reducción de 7,9 y 3,3 veces, respectivamente, de la sensibilidad vírica al saquinavir. Mutaciones de la proteasa como M36I, I54V, K57R y L63V se desarrollaron con menos frecuencia en presencia del saquinavir. Resistencia in vivo: Pacientes no pretratados: En cuatro estudios se han evaluado dos regímenes de saquinavir/ritonavir en pacientes que no habían recibido antes tratamiento antirretrovírico (saquinavir/ritonavir: 1.600 mg/100 mg al día [n = 349]; 1.000 mg/100 mg dos veces al día [n = 92]). Se realizaron análisis basales en 26 pacientes que habían experimentado un rebrote vírico. Se excluyeron los datos de 2 pacientes, bien por presentar éstos antes del estudio mutaciones asociadas a resistencia a inhibidores de la proteasa, bien por haber desarrollado posteriormente una mutación de la proteasa D30N asociada con otro inhibidor de la proteasa. Los virus de 2 pacientes (2/24) desarrollaron mutaciones de la proteasa (M36I y M46i/m, respectivamente). Estas mutaciones no están asociadas habitualmente con la resistencia al saquinavir. No se observaron mutaciones de la proteasa asociadas específicamente con el saquinavir que se desarrollaran tras el fracaso virológico. Pacientes tratados previamente: Se evaluó el genotipo inicial y durante el tratamiento de 22 pacientes tratados previamente con inhibidores de la proteasa que presentaron un fracaso virológico después de recibir un régimen con saquinavir/ritonavir (estudios MaxCmin 1 y MaxCmin 2; 1.000/100 mg dos veces al día, n = 171). Los virus de ocho pacientes (8/22; 36%) desarrollaron mutaciones de la proteasa adicionales tras el fracaso virológico. La incidencia relativa de cada mutación fue la siguiente: I84V (n = 4; 18%); F53L, A71V o G73S (n = 2; 9%); L10V, M46I, I54V, V82A o L90M (n = 1; 4,5%). Actividad antivírica según el genotipo y el fenotipo iniciales: Los límites clínicos genotípicos y fenotípicos predictivos de la eficacia clínica de saquinavir/ritonavir se han obtenido a partir del análisis retrospectivo de los ensayos clínicos RESIST 1 y 2 y del análisis de una cohorte hospitalaria numerosa. El fenotipo de saquinavir inicial (cambio de sensibilidad con relación a la referencia, ensayo PhenoSense) demostró ser un factor predictivo del resultado virológico. Primero se observó una disminución de la respuesta virológica cuando el cambio era superior a 2,3 veces, mientras que no se observó ningún beneficio virológico cuando el cambio era superior a 12 veces. En un estudio de cohortes (Marcelin et al. 2007) se identificaron 9 codones de la proteasa (L10F/I/M/R/V, I15A/V, K20I/M/R/T, L24I, I62V, G73S/T, V82A/F/S/T, I84V, L90M) que estaban asociados a la disminución de la respuesta virológica a saquinavir/ritonavir (1.000/100 mg dos veces al día) en 138 pacientes que no fueron tratados previamente con saquinavir. La presencia de 3 o más mutaciones se asoció a una respuesta reducida a saquinavir/ritonavir. La relación entre el número de estas mutaciones asociadas a la resistencia al saquinavir y la respuesta virológica se confirmó utilizando una base de datos independiente; la relación se estudió con los datos de pacientes tratados con saquinavir/ritonavir en los ensayos clínicos RESIST 1 y 2. En estos estudios participó una población de pacientes muy pretratados, incluido un 54% que habían recibido saquinavir con anterioridad. El análisis confirmó la relación entre el número de mutaciones asociadas a la resistencia al saquinavir (p = 0,0133; v. Tabla 3). Además, la mutación G48V, previamente identificada in vitro como una mutación por saquinavir, estaba presente antes de comenzar el estudio en los virus de 3 pacientes, ninguno de los cuales respondió al tratamiento. La respuesta virológica al tratamiento antirretrovírico de gran actividad (TARGA) depende de la actividad de cada antirretrovírico. Para evaluar la relación entre la cifra inicial de mutaciones asociadas a la resistencia al saquinavir y la actividad de los antirretrovíricos utilizados concomitantemente en el régimen se utilizaron los datos iniciales sobre la sensibilidad fenotípica. La asociación entre la cifra inicial de mutaciones asociadas con la resistencia al saquinavir y la respuesta virológica era muy significativa si se tenía en cuenta la actividad del tratamiento de fondo optimizado (p = 0,0011; v. Tabla 4). Los pacientes que recibieron saquinavir en presencia de tratamiento antirretrovírico activo concomitante y que presentaban menos mutaciones asociadas con la resistencia al saquinavir tuvieron mejor respuesta en comparación con los que recibieron menos comedicación activa y que presentaban cifras más altas de mutaciones asociadas a la resistencia al saquinavir.
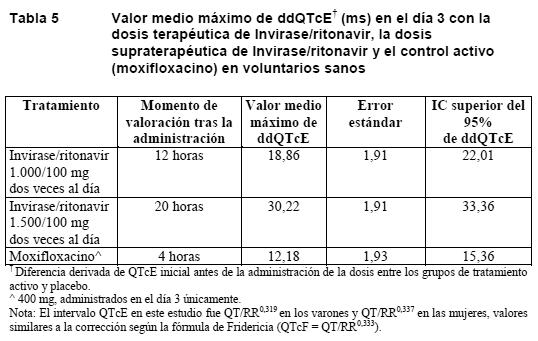
Eficacia / Estudios clínicos: Se han evaluado los efectos del saquinavir en combinación con zalcitabina (con o sin zidovudina) sobre el desenlace clínico y los marcadores biológicos (número de linfocitos CD4 y ARN plasmático) en pacientes infectados por el VIH-1, con o sin tratamiento antirretrovírico anterior. En un amplio estudio clínico abierto y aleatorizado (MaxCmin 1), llevado a cabo en pacientes adultos infectados por el VIH-1, se estudiaron los efectos de saquinavir en cápsulas de gelatina blanda (1.000 mg) en combinación con ritonavir (100 mg), administrados dos veces al día. En el estudio NV14256, que se llevó a cabo en pacientes previamente tratados con zidovudina (CD4 ≥ 50; ≤300 células/mm3), el tiempo transcurrido hasta el inicio de la primera enfermedad definidora de sida o la muerte fue mayor en los pacientes tratados con saquinavir y zalcitabina que en los que recibieron sólo zalcitabina. Con la biterapia disminuyó en un 53% el riesgo de que un paciente falleciera o presentara una enfermedad definidora de sida; en cuanto al riesgo de muerte, la biterapia consiguió reducirlo en un 72%. Estas cifras corresponden a una reducción de la tasa de enfermedades definidoras de sida o muerte de un 29,4% a un 16,0% durante un período de 18 meses; en lo referente al riesgo de muerte durante 18 meses, la tasa disminuyó del 8,6% al 4,1%. En los tres grupos, la mediana de la duración del tratamiento fue de 11 a 13 meses, y la mediana del período de seguimiento fue de 17 meses. En este estudio, la mediana de la cifra inicial de linfocitos CD4 en todos los grupos de tratamiento fue de 156-176 linfocitos CD4/mm3. El cambio medio con respecto a los valores iniciales a lo largo de 16 semanas (mediana de DAVG16) con saquinavir y zalcitabina fue de +26 linfocitos CD4/mm3 y de -0,6 log10 en el caso del número de copias de ARN por ml de plasma. El mayor aumento de la cifra de linfocitos CD4 fue de 47 linfocitos CD4/mm3, en la semana 16. La reducción máxima de la viremia fue de 0,7 log10 copias/ml, en la semana 12. En el estudio SV14604, un ensayo de fase III aleatorizado, multicéntrico y con doble enmascaramiento, se compararon la biterapia con zidovudina y zalcitabina, la biterapia con saquinavir y zidovudina, y la triterapia con saquinavir, zidovudina y zalcitabina en pacientes infectados por el VIH que habían sido mínimamente tratados o no habían recibido tratamiento previo con antirretrovíricos. Se suspendió prematuramente un cuarto grupo terapéutico con zidovudina en monoterapia; los pacientes inicialmente incluidos en él pasaron a recibir triterapia con saquinavir, zidovudina y zalcitabina y constituyeron un grupo de triterapia "tardía". En total, 3.485 pacientes recibieron tratamiento y disponían de datos de seguimiento (población por intención de tratar). La mediana de las cifras iniciales de linfocitos CD4 en los tres grupos de tratamiento fue de 199 y 204 linfocitos CD4/mm3, y la mediana del número inicial de copias de ARN del VIH por mililitro de plasma fue de 5,0-5,1 log10 copias/ml. La mediana de la duración del tratamiento fue de unos 14 meses, y la mediana del período de seguimiento de las enfermedades definidoras de sida o muerte fue aproximadamente de 17 meses. La progresión hasta la aparición de la primera enfermedad definidora de sida o muerte fue significativamente menor en los pacientes bajo triterapia (76 casos, frente a los 142 registrados en el grupo con zidovudina más zalcitabina; p = 0,0001). Una comparación exploradora entre el grupo con triterapia "inicial" y el grupo con triterapia "tardía" puso de manifiesto la superioridad de la triterapia inicial con saquinavir (76 casos de enfermedad definidora de sida o muerte, frente a 116 en el grupo con monoterapia con zidovudina inicial y triterapia tardía; p = 0,001). El aumento del número de linfocitos CD4 fue mayor entre los pacientes tratados con triterapia (mediana del aumento máximo con respecto a los valores iniciales de 71 linfocitos CD4/mm3) que en los que recibieron biterapia con zidovudina más zalcitabina (40 linfocitos CD4/mm3). De forma similar, la disminución de la viremia fue mayor en el grupo que recibió la triterapia (mediana del descenso máximo con respecto a los valores iniciales de copias de ARN del VIH por ml de 1,5 log10 copias/ml) que en el tratado con zidovudina más zalcitabina (1,1 log10). Tanto para el recuento de linfocitos CD4 como para la viremia, las comparaciones durante las 48 semanas de seguimiento entre el grupo que recibió la triterapia y el grupo tratado con zidovudina más zalcitabina alcanzaron significación estadística (p = 0,0001). Invirase en monoterapia ha demostrado tener únicamente una actividad antivírica escasa y pasajera. Por lo tanto, Invirase debe combinarse siempre con otros antirretrovíricos. En el estudio MaxCmin 1, la seguridad y la eficacia del saquinavir en cápsulas de gelatina blanda/ritonavir en dosis de 1.000/100 mg dos veces al día administrados con 2 INTI/INNTI se compararon con las de indinavir/ritonavir en dosis de 800/100 mg dos veces al día junto con 2 INTI/INNTI. En el grupo tratado con saquinavir/ritonavir, la mediana del número inicial de linfocitos CD4 fue de 272 por mm3, y la mediana de la cifra inicial de copias de ARN del VIH por mililitro de plasma, de 4,0 log10 copias/ml. En el grupo tratado con indinavir/ritonavir, la mediana del número inicial de linfocitos CD4 fue de 280 por mm3, y la mediana de la cifra inicial de copias de ARN del VIH por mililitro de plasma, de 3,9 log10 copias/ml. Después de 48 semanas, el aumento de la cifra de linfocitos CD4 fue, respectivamente, de 85 y 73 por mm3 en los grupos de saquinavir e indinavir. Al realizar el análisis por intención de tratar (cambio = fracaso) en la semana 48, la proporción de pacientes con una viremia por debajo del límite de detección ( < 400 copias/ml) era del 69% (n = 102) en el grupo tratado con saquinavir y del 53% en el grupo que recibió indinavir. En el estudio MaxCmin 2, la seguridad y la eficacia del saquinavir en cápsulas de gelatina blanda/ritonavir en dosis de 1.000/100 mg dos veces al día administrados junto con 2 INTI/INNTI se compararon con las de lopinavir/ritonavir en dosis de 400/100 mg dos veces al día junto con 2 INTI/INNTI en más de 324 sujetos. En el grupo tratado con saquinavir/ritonavir, la mediana de la cifra inicial de linfocitos CD4 era de 241 por mm3, y la mediana del número inicial de copias de ARN del VIH por ml de plasma, de 4,4 log10. En el grupo tratado con lopinavir/ritonavir, la mediana de la cifra inicial de linfocitos CD4 era de 239 por mm3 y la mediana del número inicial de copias de ARN del VIH por ml de plasma, de 4,6 log10. A las 48 semanas, la proporción de sujetos con una viremia por debajo del límite de detección ( < 50 copias/ml) era del 53% (n = 161) en el grupo tratado con saquinavir y del 60% (n = 163) en el grupo tratado con lopinavir al realizar el análisis por intención de tratar (cambio = fracaso), mientras que en el análisis en tratamiento (p = no significativo en ambas comparaciones) la proporción de sujetos con una viremia por debajo del límite de detección era del 74% (n = 114) en el grupo con saquinavir frente al 70% (n = 141) en el grupo que recibió lopinavir. La combinación de saquinavir y ritonavir puso de manifiesto una actividad virológica comparable a la del grupo tratado con lopinavir más ritonavir cuando el cambio del tratamiento asignado se contabilizó como fracaso virológico. En el transcurso de 48 semanas se observó una intensa respuesta inmunológica, similar en ambos grupos; la mediana del aumento del recuento de linfocitos CD4 fue de 106 por mm3 en el grupo tratado con lopinavir/ritonavir y de 110 por mm3 en el grupo que recibió saquinavir/ritonavir. No se observaron diferencias en la incidencia de acontecimientos adversos de grados 3 y 4 entre ambos grupos. Efectos en el electrocardiograma: En un estudio de cuatro vías cruzado, con doble enmascaramiento, controlado con placebo y con tratamiento activo (400 mg de moxifloxacino) realizado en voluntarios sanos de ambos sexos, de edad comprendida entre 18 y 55 años (N = 59), se evaluó durante 20 horas en el día 3 de la administración el efecto de 1.000/100 mg dos veces al día (dosis terapéutica) y de 1.500/100 mg dos veces al día (dosis supraterapéutica) de Invirase/ritonavir en el intervalo QT. Se eligió el día 3 para la determinación porque la exposición farmacocinética había sido máxima en ese día en un estudio farmacocinético anterior con dosis múltiples de 14 días de duración. Con las dosis señaladas de Invirase/ritonavir en el día 3 de este estudio, la media de la Cmáx registrada fue unas 3 y 4 veces más alta, respectivamente, que la media de la Cmáx en estado estacionario observada con 1.000/100 de Invirase/ritonavir dos veces al día en pacientes infectados por el VIH. En el día 3, el límite superior del intervalo de confianza unilateral del 95% de la diferencia media máxima en el QTcE (intervalo QT corregido por la frecuencia cardíaca específicamente para el estudio) inicial anterior a la administración de la dosis entre los grupos que recibieron el principio activo y el placebo fue > 10 ms en los dos grupos de tratamiento con Invirase/ritonavir (ver los resultados en Tabla 5). La dosis supraterapéutica de Invirase/ritonavir parecía tener un efecto mayor en el intervalo QT que la dosis terapéutica. La mayoría de los sujetos (el 89% y el 80% con la dosis terapéutica y la supraterapéutica, respectivamente) presentaban un QTcE < 450 ms y ninguno un intervalo QTc > 500 ms (ver Anomalías de la conducción cardíaca en Advertencias).
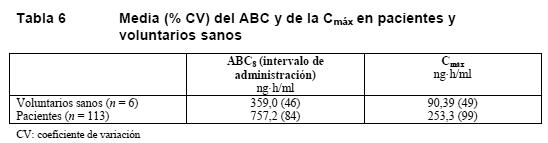
En este estudio también se observó en el día 3 una prolongación del intervalo PR > 200 ms en el 40% y el 47%, respectivamente, de los sujetos tratados con 1.000/100 mg y 1.500/100 mg de Invirase/ritonavir dos veces al día. El 3% de los sujetos del grupo de control activo con moxifloxacino y el 5% de los pacientes del grupo placebo presentaron una prolongación del intervalo PR > 200 ms. Los cambios medios máximos del intervalo PR respecto del valor inicial anterior a la administración de la dosis fueron, respectivamente, de 25 ms y 34 ms en los grupos tratados con 1.000/100 mg y 1.500/100 mg de Invirase/ritonavir dos veces al día (ver Anomalías de la conducción cardíaca en Advertencias). En este estudio no se registró ningún caso de torsade de pointes (taquicardia ventricular polimorfa en entorchado) ni de prolongación del intervalo QT > 500 ms. No se pudo descartar la asociación de síncope o presíncope con la prolongación del intervalo PR en varios sujetos. No se sabe qué importancia clínica pueden tener los resultados de este estudio, realizado en voluntarios sanos, en lo que respecta al uso de Invirase/ritonavir en pacientes infectados por el VIH, pero deben evitarse las dosis de Invirase/ritonavir superiores a 1.000/100 mg dos veces al día. Propiedades farmacocinéticas: Absorción: En voluntarios sanos, el grado de absorción (determinado a partir del ABC) tras administrar una dosis oral de 600 mg de saquinavir aumentó de 24 ng·h/ml (CV: 33%) en ayunas a 161 ng·h/ml (CV: 35%) cuando el saquinavir se administraba tras un desayuno copioso (48 g de proteínas, 60 g de hidratos de carbono, 57 g de grasas; 1.006 kcal). En presencia de alimentos aumentaron también el tmáx (tiempo transcurrido hasta alcanzar la concentración plasmática máxima), de 2,4 a 3,8 horas, y sobre todo la Cmáx, de 3,0 a 35,5 ng/ml. Se ha demostrado que el efecto de los alimentos persiste hasta 2 horas. Por lo tanto, Invirase debería administrarse en el plazo de 2 horas después de una comida. En un estudio cruzado en 22 pacientes infectados por el VIH, tratados con Invirase/ritonavir en dosis de 1.000 mg/100 mg dos veces al día y que recibieron tres dosis consecutivas en ayunas o tras una comida rica en grasa y calorías (46 g de grasa, 1.091 kcal), el ABC0-12h de saquinavir fue de 10.320 ng·h/ml y de 34.926 ng·h/ml, respectivamente. En todos los pacientes salvo en uno se alcanzó una Cmín por encima del umbral terapéutico en ayunas. No obstante, Invirase/ritonavir debe administrarse en las 2 horas siguientes a una comida. En promedio, la biodisponibilidad absoluta fue del 4% (intervalo: 1%-9%) en 8 voluntarios sanos que recibieron una sola dosis de 600 mg (3 cápsulas de 200 mg) de saquinavir tras un desayuno copioso. Esta escasa biodisponibilidad se atribuye a la asociación de una absorción incompleta y un notable metabolismo de primer paso hepático. Se ha demostrado que el pH gástrico apenas influye en el notable aumento de la biodisponibilidad cuando Invirase se administra con los alimentos. Tras administrar dosis orales múltiples (25-600 mg tres veces al día) en presencia de alimentos, el aumento de la exposición al fármaco (50 veces mayor) fue más que directamente proporcional al aumento de la dosis (24 veces mayor). Tras la administración de dosis múltiples (600 mg tres veces al día) a pacientes infectados por el VIH, el ABC en equilibrio fue 2,5 veces mayor (IC del 95%: 1,6-3,8) que el observado tras una sola dosis. En los pacientes infectados por el VIH a los que se administraron tres dosis diarias de 600 mg de saquinavir con instrucciones de tomarlas después de las comidas, el ABC y la Cmáx de saquinavir eran aproximadamente el doble de los obtenidos en voluntarios sanos sometidos al mismo régimen terapéutico (ver Tabla 6).
En los pacientes infectados por el VIH, saquinavir en cápsulas de gelatina blanda o Invirase en combinación con ritonavir en dosis de 400/400 mg dos veces al día o 1.000/100 mg dos veces al día proporcionan durante períodos superiores a 24 horas exposiciones sistémicas al saquinavir similares o mayores que las obtenidas con dosis de 1.200 mg de saquinavir en cápsulas de gelatina blanda tres veces al día (ver Tabla 7).
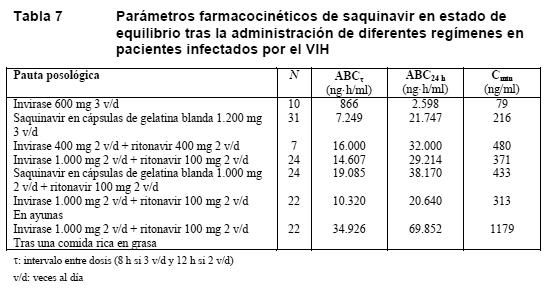
No se han observado diferencias en cuanto a la absorción gastrointestinal entre los pacientes seropositivos al VIH con diarrea y sin ella; tampoco la administración de saquinavir afectó a esta variable. El saquinavir es sustrato del transportador MDR1 vinculado a la polifarmacorresistencia (glucoproteína P). Se ha demostrado la bioequivalencia de Invirase FCT (comprimidos recubiertos de 500 mg) e Invirase HC (cápsulas duras de 200 mg) en 94 voluntarios sanos de ambos sexos que recibieron 1.000 mg (2 x 500 mg) de Invirase FCT o de Invirase HC (5 x 200 mg) con alimentos en combinación con 100 mg ritonavir dos veces al día. Se estimó que el cociente de exposición media del saquinavir era de 1,10 para el ABC0-inf y de 1,19 para la Cmáx, con un IC del 90% de 1,04-1,16 y de 1,14-1,25, respectivamente. Distribución: El saquinavir se distribuye ampliamente en los tejidos. Tras la administración intravenosa de una dosis de 12 mg de saquinavir, el volumen de distribución en equilibrio era de 700 litros (CV: 39%). El grado de unión del saquinavir a las proteínas plasmáticas es alto (98% aproximadamente) e independiente de la concentración en el intervalo de 15-700 ng/ml. En dos pacientes tratados con tres dosis diarias de 600 mg de Invirase, las concentraciones de saquinavir en el líquido cefalorraquídeo fueron insignificantes en comparación con las concentraciones plasmáticas correspondientes. Metabolismo: Estudios in vitro con microsomas de hígado humano han revelado que el metabolismo del saquinavir está mediado por el sistema del citocromo P450, siendo específicamente la isoenzima CYP3A4 responsable de más del 90% del metabolismo hepático. Según estudios in vitro, el saquinavir se metaboliza rápidamente, dando lugar a diversos compuestos inactivos monohidroxilados y dihidroxilados. Tras la administración intravenosa, el 66% del saquinavir circulante se encontraba en forma inalterada y el resto, en forma de metabolitos. Estos resultados parecen indicar que el saquinavir sufre un considerable metabolismo de primer paso hepático. El aclaramiento general del saquinavir es elevado (1,14 l/h/kg; CV: 12%), ligeramente superior al flujo plasmático hepático, y constante tras la administración intravenosa de 6, 36 y 72 mg de saquinavir. El tiempo medio de permanencia del saquinavir fue de 7 horas. Eliminación: En un estudio de balance de masas con 600 mg de saquinavir marcado con C14 (N = 8), el 88% de la radiactividad administrada por vía oral se recuperó en las heces durante los 4 primeros días, y sólo el 1% en la orina. En otros cuatro sujetos, tras la administración intravenosa de 10,5 mg de saquinavir radiomarcado con C14, el 81% de la radiactividad administrada se eliminó por las heces y el 3% por la orina durante los 4 primeros días. En los estudios de balance de masas tras la administración oral, el 13% del saquinavir plasmático circulante se encontraba en forma inalterada y el resto, en forma de metabolitos. Farmacocinética en poblaciones especiales: Pacientes con insuficiencia renal: No se han realizado estudios farmacocinéticos de Invirase en pacientes con insuficiencia renal. Pacientes con insuficiencia hepática: En 7 pacientes infectados por el VIH con insuficiencia hepática moderada (clase B de Child-Pugh, 7-9 puntos) se estudió el efecto de la insuficiencia hepática en la farmacocinética en estado de equilibrio de saquinavir/ritonavir (1.000 mg/100 mg dos veces al día, durante 14 días). El estudio comprendía un grupo de control de 7 pacientes infectados por el VIH con función hepática normal, equiparables en edad, sexo, peso y consumo de tabaco a los pacientes con insuficiencia hepática. Los valores medios (coeficiente porcentual de variación entre paréntesis) de ABC0-12h y Cmáx de saquinavir fueron 24,3 (102%) mg·hr/ml y 3,6 (83%) mg/ml, respectivamente, en los pacientes infectados por el VIH con insuficiencia hepática moderada. Los valores correspondientes en el grupo de control fueron 28,5 (71%) mg·hr/ml y 4,3 (68%) mg/ml. El cociente de las medias geométricas (entre parámetros farmacocinéticos en los pacientes con insuficiencia hepática y los pacientes con función hepática normal) (IC del 90%) fue de 0,7 (0,3-1,6) tanto con el ABC0-12h como con la Cmáx; este valor indica una reducción aproximada del 30% de la exposición farmacocinética en los pacientes con insuficiencia hepática moderada. No se requiere ajustar la dosis de saquinavir en los pacientes infectados por el VIH que presenten insuficiencia hepática moderada (ver Advertencias e Insuficiencia hepática). Efectos del sexo, la raza o la edad: No se observó ningún efecto en función del sexo sobre la farmacocinética de las cápsulas de 200 mg de Invirase administradas como dosis única de 600 mg en 71 voluntarios sanos. En el estudio comparativo de bioequivalencia con los comprimidos recubiertos de 500 mg y las cápsulas de 200 mg de Invirase en combinación con ritonavir, se observó una diferencia en función del sexo: la exposición al saquinavir fue mayor en las mujeres que en los hombres (ABC: 56%; Cmáx: 26%). No se observaron indicios de que la edad o el peso corporal pudieran explicar esta diferencia en función del sexo. Con la pauta aprobada, no se han notificado diferencias clínicamente significativas de seguridad y eficacia entre los hombres y las mujeres. El tratamiento de los pacientes de ambos sexos con 1.000 mg/100 mg de saquinavir/ritonavir dos veces al día se considera seguro y eficaz. No se ha determinado la influencia de la raza en la farmacocinética de Invirase. No se han estudiado las características farmacocinéticas de Invirase en ancianos ( > 65 años) ni en niños y adolescentes ( < 16 años) (ver Advertencias, Niños y ancianos). Datos preclínicos sobre seguridad: Carcinogenicidad: En los estudios de carcinogenicidad no se hallaron indicios de actividad carcinógena en ratones y ratas tratados con saquinavir durante aproximadamente 2 años. La exposición plasmática (valores de ABC) en la especie respectiva fue aproximadamente del 37% y el 85% de la obtenida en el ser humano con la dosis clínica recomendada de Invirase (1.000 mg 2 v/d) más ritonavir (100 mg 2 v/d). Mutagenicidad: Los estudios de mutagenicidad y genotoxicidad, con y sin activación metabólica, según procediera, han demostrado que saquinavir no tiene efectos mutágenos in vitro en células bacterianas (prueba de Ames) ni en células de mamífero (ensayo con células V79/HPRT de pulmón de hámster chino). Saquinavir no provocó alteraciones cromosómicas en la prueba in vivo de micronúcleos en ratones ni en linfocitos de sangre periférica humana; en el ensayo in vitro de síntesis de ADN no programada tampoco provocó alteraciones primarias del ADN. Trastornos de la fecundidad: Ni la fecundidad ni la función reproductora se vieron afectadas en ratas sometidas a exposiciones plasmáticas (valores de ABC) cercanas al 33% de las que se obtienen en humanos con la dosis recomendada de Invirase (1.000 mg 2 v/d) potenciado con ritonavir (100 mg 2 v/d). Teratogenicidad: No se observaron efectos embriotóxicos ni teratógenos en ratas y conejos sometidos a exposiciones plasmáticas (valores de ABC) cercanas al 32% de las que se obtienen en humanos con la dosis recomendada de Invirase (1.000 mg 2 v/d) potenciado con ritonavir (100 mg 2 v/d).
Indicaciones.
Invirase está indicado para el tratamiento de pacientes adultos infectados por el VIH-1. Invirase sólo puede administrarse en asociación con otros medicamentos antirretrovirales y no puede administrase como único inhibidor de proteasa.
Dosificación.
Cuestiones que deben considerarse al empezar el tratamiento con Invirase: Invirase siempre debe administrarse en combinación con ritonavir. En los pacientes que estén tomando Invirase sin ritonavir (Invirase no potenciado) y presenten una reducción virológica adecuada sin sospechas clínicas de resistencia, debe considerarse la posibilidad de cambiar a Invirase con ritonavir (Invirase potenciado o Invirase/ritonavir). En los pacientes que reciban Invirase no potenciado, que no estén respondiendo al tratamiento o respondan de manera insuficiente y que presenten indicios clínicos de resistencia al saquinavir, no se recomienda cambiar el tratamiento a Invirase/ritonavir sin una evaluación clínica minuciosa, y deberían sopesarse otras opciones terapéuticas (ver Propiedades farmacocinéticas). Los adultos y niños que no puedan ingerir los comprimidos recubiertos de Invirase deberían tomar las cápsulas de 200 mg. Adultos y adolescentes mayores de 16 años: Saquinavir potenciado: Invirase siempre debe administrarse en combinación con ritonavir. La pauta posológica recomendada es la siguiente: 1.000 mg de Invirase dos veces al día con 100 mg de ritonavir dos veces al día en combinación con otros antirretrovíricos. Ritonavir debe tomarse simultáneamente con Invirase, en un plazo de 2 horas después de una comida (ver Propiedades farmacocinéticas). Saquinavir administrado con otros inhibidores de la proteasa: Por lo que respecta a la posología recomendada y los posibles efectos adversos de otros antirretrovíricos usados en politerapia, véase la información completa para el prescriptor de los correspondientes medicamentos. Como ocurre con todos los tratamientos antirretrovíricos, es muy importante respetar la pauta prescrita. Pautas posológicas especiales: Si se presentan efectos secundarios graves que puedan estar relacionados con Invirase, se debe suspender su administración. No se recomiendan dosis de Invirase inferiores a 600 mg tres veces al día. Es posible que la combinación con otros antirretrovíricos (por ejemplo, ritonavir) haga necesaria una modificación posológica de los inhibidores de la proteasa, dado que podría aumentar la concentración plasmática (ver Interacciones y Dosificación). Para las pautas posológicas en poblaciones especiales, v. Uso en pediatría, Uso en geriatría, Insuficiencia renal e Insuficiencia hepática.
Contraindicaciones.
Invirase/ritonavir está contraindicado en pacientes con hipersensibilidad al saquinavir, al ritonavir o a cualquier otro componente de las cápsulas o los comprimidos recubiertos. Invirase/ritonavir no debe administrarse junto con fármacos con los que podría interactuar y provocar efectos secundarios potencialmente mortales. La Tabla 1 recoge los fármacos que no deben administrarse con Invirase/ritonavir (ver también Interacciones). Invirase/ritonavir está contraindicado en pacientes con prolongación congénita o adquirida documentada del intervalo QT y con trastornos electrolíticos, particularmente la hipopotasemia no corregida. Está contraindicada la administración de Invirase/ritonavir con algunos fármacos que presentan interacciones farmacocinéticas y que asimismo prolongan el intervalo QT, el intervalo PR o ambos (ver Interacciones).
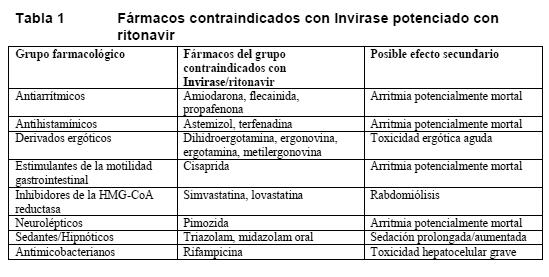
Invirase/ritonavir está contraindicado en pacientes con insuficiencia hepática grave (ver Advertencias).
Reacciones adversas.
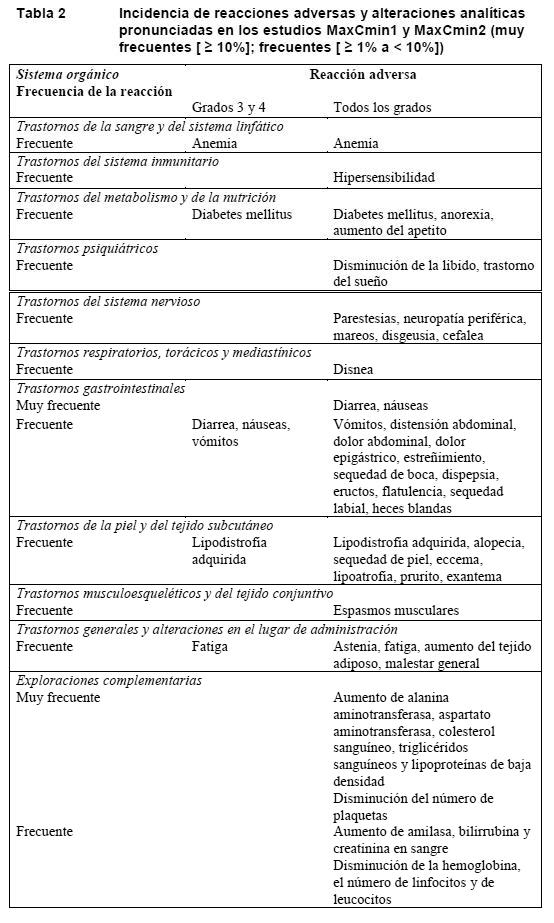
Ensayos clínicos: Los acontecimientos adversos notificados con mayor frecuencia y con una relación al menos posible con saquinavir/ritonavir han sido náuseas, diarrea, fatiga, vómitos, flatulencia y dolor abdominal. Reacciones adversas en los ensayos clínicos con saquinavir potenciado con ritonavir: Existen datos limitados de dos estudios en los que se evaluó en 311 pacientes la seguridad de saquinavir en cápsulas de gelatina blanda (1.000 mg dos veces al día) en combinación con una dosis baja de ritonavir (100 mg dos veces al día) durante un mínimo de 48 semanas. Las reacciones adversas en estos estudios fundamentales se resumen en la Tabla 2, que también contiene las alteraciones analíticas pronunciadas que se observaron con saquinavir en cápsulas de gelatina blanda en combinación con ritonavir (al cabo de 48 semanas). Dentro de cada grupo de frecuencia, los efectos adversos se presentan en orden decreciente de gravedad.
Para mayor exhaustividad se señalan también las siguientes reacciones adversas que se han notificado en los ensayos clínicos con saquinavir no potenciado y no se presentan en la tabla anterior: Trastornos del sistema nervioso: hipoestesia, anomalías de la coordinación y hemorragia intracraneal. Trastornos psiquiátricos: estado confusional, depresión, ansiedad, intento de suicidio, insomnio y trastorno de la libido. Trastornos de la piel y del tejido subcutáneo: síndrome de Stevens-Johnson, dermatitis ampollosa, erupción medicamentosa y reacción cutánea grave asociada a elevación de los valores de las pruebas de la función hepática. Trastornos hepatobiliares: ictericia, hipertensión portal y agudización de hepatopatía crónica con elevación de grado 4 de los resultados de las pruebas de la función hepática. Trastornos generales y reacciones en el sitio de administración: pirexia, ulceración de la mucosa y dolor pectoral. Trastornos musculoesqueléticos y del tejido conjuntivo: debilidad muscular y poliartritis. Trastornos de la sangre y del sistema linfático: anemia hemolítica y neutrocitopenia. Trastornos gastrointestinales: ascitis, pancreatitis y obstrucción intestinal. Exploraciones complementarias: aumento de la creatina-cinasa sanguínea y de la glucemia; disminución de la glucemia. Trastornos del metabolismo y de la nutrición: disminución del apetito. Neoplasias benignas, malignas y no especificadas (incluidos quistes y pólipos): papiloma cutáneo, leucemia mieloide aguda. Trastornos renales y urinarios: nefrolitiasis. Trastornos vasculares: vasoconstricción. Experiencia con saquinavir tras la comercialización: A continuación se resumen las reacciones adversas de las notificaciones espontáneas tras la comercialización (con saquinavir administrado como único inhibidor de la proteasa o en combinación con ritonavir) que no se recogen en el apartado Ensayos clínicos y en las que no cabe excluir una relación causal con el saquinavir. Dado que estos datos proceden del sistema de notificaciones espontáneas, se desconoce la frecuencia de estas reacciones adversas. Trastornos del sistema inmunitario: Hipersensibilidad. Trastornos del metabolismo y la nutrición: Diabetes mellitus o hiperglucemia, en ocasiones asociada a cetoacidosis (ver Advertencias). Lipodistrofia: La politerapia antirretrovírica se ha asociado con redistribución de la grasa corporal (lipodistrofia) en pacientes infectados por el VIH (pérdida de grasa subcutánea periférica y facial, aumento de la grasa intraabdominal y visceral, hipertrofia mamaria y acumulación de grasa dorsocervical ("joroba de bisonte"). La politerapia antirretrovírica también se ha asociado con anomalías metabólicas, como hipertrigliceridemia, hipercolesterolemia, resistencia a la insulina, hiperglucemia e hiperlactatemia (ver Advertencias). Trastornos neurológicos: Somnolencia, convulsiones. Trastornos vasculares: Se ha descrito un aumento de las hemorragias (hematomas cutáneos espontáneos y hemartrosis) en hemofílicos de tipo A y B tratados con inhibidores de la proteasa (ver Advertencias). Trastornos hepatobiliares: Hepatitis.
Advertencias.
Aspectos que deben considerarse al empezar el tratamiento con Invirase: Invirase no debe administrarse sin ritonavir (no potenciado). Invirase siempre debe administrarse en combinación con ritonavir (potenciado) (ver Dosificación). Los pacientes deben saber que el saquinavir no cura la infección por el VIH, de modo que pueden seguir adquiriendo enfermedades asociadas con la infección por el VIH avanzada, como las infecciones oportunistas. También se debe advertir a los pacientes de que podrían presentar reacciones adversas asociadas a los medicamentos administrados simultáneamente. Insuficiencia hepática: No es necesario ajustar la dosis en los pacientes infectados por el VIH con insuficiencia hepática moderada, según los pocos datos de los que se dispone (ver Insuficiencia hepática y Farmacocinética en poblaciones especiales). En pacientes con hepatitis B o C subyacente, cirrosis, alcoholismo crónico u otras alteraciones hepáticas subyacentes, se han descrito casos de empeoramiento de la hepatopatía y desarrollo de hipertensión portal al comenzar el tratamiento con saquinavir. Entre los síntomas asociados se cuentan los siguientes: ictericia, ascitis, edema y, en ocasiones, várices esofágicas. Varios de estos pacientes fallecieron. No se ha determinado que exista una relación causal entre el tratamiento con saquinavir y el desarrollo de hipertensión portal (ver Contraindicaciones). Debe considerarse la conveniencia de aumentar la vigilancia de los signos y síntomas de hepatotoxicidad. Insuficiencia renal: Dado que el saquinavir se metaboliza y se elimina principalmente por vía hepática, el aclaramiento renal constituye tan sólo una vía de eliminación secundaria. Por lo tanto, no es necesario reducir la dosis habitual en los pacientes con insuficiencia renal (ver Insuficiencia renal). Ahora bien, dado que no se han realizado estudios en pacientes con insuficiencia renal grave, se recomienda actuar con precaución en tales casos. Niños y ancianos: No se han determinado la seguridad ni la eficacia del saquinavir en pacientes menores de 16 años infectados por el VIH. Los datos disponibles sobre niños tratados con cápsulas de gelatina blanda de saquinavir no potenciado son pocos, y no se dispone de información sobre niños tratados con Invirase no potenciado. Dado que las concentraciones plasmáticas de saquinavir son significativamente más bajas en los niñ
os que en los adultos, Invirase no potenciado no debe utilizarse en aquéllos. La combinación de saquinavir en cápsulas de gelatina blanda (50 mg/kg dos veces al día) y nelfinavir o ritonavir en niños incrementa considerablemente la exposición al saquinavir. En combinación con ritonavir, la exposición al saquinavir podría ser hasta dos veces mayor que la obtenida en adultos con 1.200 mg de saquinavir en cápsulas de gelatina blanda tres veces al día. La experiencia con pacientes mayores de 60 años es escasa. Intolerancia a la lactosa: Cada comprimido recubierto contiene 38,5 mg de lactosa (monohidrato). No deben tomar estos medicamentos los pacientes con problemas hereditarios de intolerancia a la galactosa, deficiencia de lactasa de los lapones o malabsorción de glucosa-galactosa (trastorno autosómico-recesivo). Hemofilia: Se ha descrito un aumento de las hemorragias (por ejemplo, hematomas cutáneos espontáneos y hemartrosis) en hemofílicos de tipos A y B tratados con inhibidores de la proteasa. A algunos pacientes se les administró factor VIII. En más de la mitad de los casos notificados, el tratamiento con inhibidores de la proteasa no se suspendió o pudo reintroducirse tras una interrupción pasajera. Se ha invocado una posible relación causal, aunque todavía se desconoce cuál puede ser el mecanismo de acción. Así pues, se debe informar a los pacientes hemofílicos sobre la posibilidad de que aumenten las hemorragias. Diabetes mellitus e hiperglucemia: Se han descrito casos de diabetes mellitus de desarrollo reciente, hiperglucemia o empeoramiento de una diabetes preexistente en pacientes tratados con inhibidores de la proteasa. En algunos de ellos, la hiperglucemia era grave y en ocasiones se asoció a cetoacidosis. Muchos pacientes presentaban complicaciones médicas, algunas de las cuales requerían tratamiento con fármacos que se han asociado con el desarrollo de diabetes mellitus o hiperglucemia. No se ha establecido una relación causal entre el tratamiento con inhibidores de la proteasa y la aparición de hiperglucemia o diabetes mellitus. Redistribución del tejido adiposo: En los pacientes que reciben politerapia antirretrovírica se ha observado redistribución y acumulación del tejido adiposo corporal, consistente en obesidad central, aumento del tejido adiposo dorsocervical (cuello de bisonte), emaciación periférica, hipertrofia mamaria y "aspecto cushingoide". La politerapia antirretrovírica se ha asociado también a anomalías metabólicas, como hipertrigliceridemia, hipercolesterolemia, resistencia a la insulina e hiperglucemia. La gravedad de estos trastornos metabólicos varía dentro de cada uno de los tres grupos de antirretrovíricos y entre ellos (inhibidores de la proteasa, inhibidores nucleosídicos de la transcriptasa inversa [INTI] e inhibidores no nucleosídicos de la transcriptasa inversa [INNTI]). La edad avanzada, una larga duración del tratamiento antirretrovírico, el uso de estavudina, la hipertrigliceridemia y la hiperlacticemia comportan un mayor riesgo de lipodistrofia. La exploración clínica debe incluir la evaluación de los signos físicos de redistribución del tejido adiposo. Se aconseja vigilar la lipidemia y la glucemia. En caso de alteraciones metabólicas, debe considerarse la posibilidad de cambiar el tratamiento antirretrovírico o administrar un tratamiento específico para corregirlas (por ejemplo, con hipolipidemiantes). En la actualidad, se desconocen los mecanismos de estos fenómenos y las consecuencias a largo plazo, incluido el aumento del riesgo de enfermedades cardiovasculares (ver Reacciones adversas). Interacciones farmacológicas: Interacción con el ritonavir: La dosis recomendada es de 1.000 mg de Invirase más 100 mg de ritonavir, ambos administrados dos veces al día. Se ha comprobado que dosis superiores de ritonavir van acompañadas de una mayor incidencia de reacciones adversas. La concentración plasmática de saquinavir aumenta cuando se administra junto con ritonavir. En algunos casos, la coadministración de saquinavir y ritonavir ha ocasionado acontecimientos adversos graves, sobre todo cetoacidosis diabética y trastornos hepáticos, especialmente en hepatópatas (ver Interacciones). Interacciones con rifampicina, rifabutina y efavirenz: Cuando se utiliza en combinación con otro tratamiento antirretrovírico, Invirase no potenciado no debe administrarse concomitantemente con rifabutina, rifampicina o efavirenz, pues ello provocaría una reducción significativa de las concentraciones plasmáticas de saquinavir. Se recomienda ajustar la dosis de rifabutina (150 mg cada dos días) cuando se utilice en combinación con Invirase/ritonavir (ver Interacciones). Son pocos los datos que respaldan el uso de saquinavir con efavirenz cuando se coadministra con ritonavir. Rifampicina no debe administrarse a pacientes en tratamiento con Invirase/ritonavir como parte de un régimen antirretrovírico, a causa del riesgo de toxicidad hepatocelular grave que se observó en un estudio de interacciones medicamentosas en voluntarios sanos (ver Contraindicaciones, Interacciones y Ensayos clínicos). Interacción con Hypericum perforatum y cápsulas de ajo: Dado el riesgo de que disminuyan las concentraciones plasmáticas y el efecto clínico de saquinavir, no deben tomarse productos con Hypericum perforatum (hipérico, corazoncillo, hierba de San Juan) ni cápsulas de ajo durante el tratamiento con Invirase no potenciado (ver Interacciones). Interacciones con los inhibidores de la HMG-CoA reductasa: Las concentraciones plasmáticas de inhibidores de la HMG-CoA reductasa metabolizados principalmente por la isoenzima CYP3A4 del citocromo P450 (por ejemplo, simvastatina y lovastatina) pueden aumentar si se coadministran con Invirase/ritonavir (ver Interacciones). Dado que las concentraciones elevadas de simvastatina y lovastatina pueden provocar ocasionalmente acontecimientos adversos graves como mialgia y rabdomiólisis, debe evitarse la combinación de Invirase/ritonavir con estos dos fármacos (ver Contraindicaciones). También deben tomarse precauciones si Invirase/ritonavir se coadministra con atorvastatina y cerivastatina, compuestos metabolizados en menor medida por CYP3A4. En este caso, debería considerarse la posibilidad de administrar una dosis reducida de atorvastatina y cerivastatina. Se recomienda utilizar pravastatina o fluvastatina siempre que esté indicado un tratamiento con inhibidores de la HMG-CoA reductasa (ver Interacciones). Interacciones con anticonceptivos orales: Dado que la concentración de etinil-estradiol puede disminuir cuando se administra conjuntamente con Invirase/ritonavir, la utilización de anticonceptivos orales estrogénicos exige adoptar métodos anticonceptivos alternativos o adicionales (ver Interacciones). Interacciones con el tipranavir: El uso simultáneo de saquinavir/ritonavir con tipranavir en un régimen de refuerzo doble se traduce en un descenso significativo de la concentración plasmática de saquinavir. Por consiguiente, no se recomienda la coadministración de saquinavir/ritonavir con tipranavir (ver Interacciones). Interacciones con la digoxina: El uso simultáneo de saquinavir/ritonavir con digoxina conlleva un aumento significativo de la concentración sérica de digoxina. Cuando se administren concomitantemente saquinavir/ritonavir y digoxina, debe procederse con cautela: se reducirá la dosis de digoxina y se vigilará su concentración sérica (ver Interacciones). Anomalías de la conducción cardíaca y de la repolarización: Se han observado prolongaciones proporcionales a la dosis de los intervalos QT y PR en voluntarios sanos que recibieron Invirase/ritonavir. Invirase/ritonavir está contraindicado en pacientes con prolongación congénita o adquirida documentada del intervalo QT y con trastornos electrolíticos, particularmente la hipopotasemia no corregida. Antecedentes familiares de muerte repentina en una edad joven pueden sugerir una prolongación congénita del intervalo QT. Está contraindicada la administración de Invirase/ritonavir con algunos fármacos que dan lugar a interacciones farmacocinéticas y que asimismo prolongan el intervalo QT, el intervalo PR o ambos (ver Contraindicaciones e Interacciones). No se recomienda administrar Invirase/ritonavir a pacientes que reciban concomitantemente otros medicamentos que prolonguen el intervalo QT. Si se considera preciso su uso, es aconsejable actuar con cautela y se debe realizar un ECG si aparecen signos de arritmias cardíacas. Invirase/ritonavir debe utilizarse con precaución en pacientes que padezcan una cardiopatía estructural y en pacientes con antecedentes de anomalías del sistema de conducción cardíaca y con cardiopatía isquémica o miocardiopatías, ya que éstos pueden tener mayor riesgo de sufrir anomalías de la conducción cardíaca. Se suspenderá la administración de Invirase/ritonavir si aparecen arritmias importantes o una prolongación significativa de los intervalos QT o PR. Generalmente las mujeres y los ancianos pueden ser más propensos a los efectos sobre el intervalo QT asociados al fármaco. La magnitud de la prolongación de los intervalos QT y PR puede aumentar a medida que se elevan las concentraciones del fármaco, por lo que no debe superarse la dosis recomendada de Invirase/ritonavir. No se ha estudiado el riesgo de prolongación del intervalo QT asociado con Invirase en una dosis de 2.000 mg 1 vez al día potenciado con ritonavir en una dosis de 100 mg 1vez al día, por lo que no se recomienda su administración. Pacientes que comiencen el tratamiento con Invirase/ritonavir: Antes de empezar la administración, debe realizarse un ECG. Los pacientes con un intervalo QT > 450 mseg no deben recibir Invirase/ritonavir. En pacientes con un intervalo QT < 450 mseg se recomienda efectuar un ECG después de 2-4 días de tratamiento. En presencia de un intervalo QT > 480 mseg o una prolongación por encima del valor pretratamiento > 20 mseg debe retirarse Invirase/ritonavir. Pacientes estables con Invirase/ritonavir y que requieran medicación concomitante que pueda elevar el intervalo QT o pacientes en tratamiento que pueda elevar el intervalo QT y que requieran concomitantemente Invirase/ritonavir, sin tratamiento alternativo disponible y con unos beneficios esperados superiores a los riesgos: Antes de iniciarse el tratamiento concomitante, debe realizarse un ECG, y los pacientes con un intervalo QT > 450 mseg no deben recibir el tratamiento concomitante (ver Interacciones). En presencia de un intervalo QT basal < 450 mseg, debe realizarse un ECG en el curso del tratamiento. Si el intervalo QT aumenta posteriormente a > 480 mseg o se produce un incremento > 20 mseg después de iniciado el tratamiento concomitante, el médico se guiará por su juicio clínico para suspender la administración de Invirase/ritonavir, del tratamiento concomitante o de ambos. Efectos sobre la capacidad para conducir y utilizar máquinas: No se han realizado estudios sobre la capacidad para conducir vehículos y utilizar máquinas durante el tratamiento con Invirase. Aunque no existen pruebas de que Invirase pueda alterar la capacidad del paciente para conducir vehículos o manejar máquinas, deben tenerse en cuenta los acontecimientos adversos de Invirase (ver Reacciones adversas).
Interacciones.
La mayoría de los estudios sobre interacciones con saquinavir se han llevado a cabo con Invirase no potenciado y cápsulas de gelatina blanda de saquinavir. Se ha realizado un número reducido de estudios con Invirase/ritonavir o cápsulas de gelatina blanda de saquinavir. Las observaciones realizadas en los estudios de interacciones con saquinavir no potenciado no son necesariamente representativas de los efectos apreciados con saquinavir/ritonavir. Además, es posible que los resultados obtenidos con saquinavir en cápsulas de gelatina blanda no sean extrapolables a Invirase, y viceversa. El metabolismo del saquinavir está mediado por el citocromo P450; la isoenzima específica CYP3A4 es responsable del 90% del metabolismo hepático. Además, el saquinavir es sustrato de la glucoproteína P (gp P). Por ello, los fármacos que comparten o modifican la isoenzima CYP3A4, la gp P o ambas podrían alterar la farmacocinética del saquinavir. De igual modo, el saquinavir también podría modificar la farmacocinética de otros fármacos que son sustratos de CYP3A4 o de la gp P. El ritonavir puede afectar a la farmacocinética de otros fármacos, ya que es un potente inhibidor de CYP3A4 y de la gp P. Por ello, en caso de coadministración de saquinavir y ritonavir, deberán considerarse los posibles efectos del ritonavir en otros fármacos, como ocurre, por ejemplo, con la contraindicación de la flecainida y la propafenona (ver Resumen de características del producto de Norvir®). Considerando los datos sobre las prolongaciones proporcionales a la dosis de los intervalos QT y PR en voluntarios sanos que recibieron Invirase/ritonavir (ver Contraindicaciones, Anomalías de la conducción cardíaca en Advertencias y Efectos en el electrocardiograma en Farmacología), pueden producirse efectos aditivos sobre la prolongación de los intervalos QT y PR con las siguientes clases de fármacos: antiarrítmicos de las clases IA o III, neurolépticos, antidepresivos tricíclicos, inhibidores de la fosfodiesterasa de tipo 5 (PDE5), ciertos antimicrobianos y determinados antihistamínicos, entre otros (ver a continuación cada una de estas clases de fármacos). Este efecto podría causar un aumento del riesgo de arritmias ventriculares, sobre todo de torsade de pointes (taquicardia ventricular polimorfa en entorchado), por lo que se evitará la administración concomitante de estos fármacos con Invirase/ritonavir cuando existan otras opciones de tratamiento. Están estrictamente contraindicados los medicamentos que presentan interacciones farmacocinéticas con Invirase/ritonavir y efectos aditivos sobre la prolongación de los intervalos QT y PR. No se recomienda la combinación de Invirase/ritonavir con otros fármacos conocidos por prolongar los intervalos QT y PR, y se actuará con cautela cuando se considere necesario utilizar concomitantemente estos fármacos. Antirretrovíricos: Inhibidores nucleosídicos de la transcriptasa inversa (INTI): Didanosina: Saquinavir potenciado: Se han estudiado los efectos de una dosis única de 400 mg de didanosina en la farmacocinética del saquinavir en 8 sujetos sanos tratados con 1.600/100 mg diarios de saquinavir en cápsulas de gelatina blanda/ritonavir durante 2 semanas. La didanosina redujo el ABC (área bajo la curva de concentraciones plasmáticas) y la Cmáx (concentración plasmática máxima) del saquinavir en torno al 30% y el 25%, respectivamente, pero no influyó prácticamente en su Cmín (concentración plasmática mínima). La importancia clínica de estos cambios es dudosa. Saquinavir no potenciado: No se ha estudiado la interacción de la didanosina y el saquinavir cuando éste se administra sin ritonavir. Tenofovir: Saquinavir potenciado: La administración concomitante de fumarato de disoproxilo de tenofovir y 1.000/100 mg de Invirase/ritonavir no tuvo ningún efecto clínico significativo en la exposición al saquinavir. En 18 pacientes infectados por el VIH y tratados con 1.000/100 mg de Invirase/ritonavir dos veces al día y 300 mg de fumarato de disoproxilo de tenofovir una vez al día, los valores de ABC y Cmáx de saquinavir fueron un 1% y un 7% más bajos que los observados con la combinación de saquinavir/ritonavir solo. Cuando se administra Invirase/ritonavir en combinación con fumarato de disoproxilo de tenofovir no es necesario ningún ajuste posológico. Zalcitabina (en combinación o no con zidovudina): Saquinavir no potenciado: Se ha estudiado en adultos el uso conjunto de Invirase y zalcitabina, con y sin zidovudina. No se apreciaron cambios en la absorción, la distribución ni la eliminación de ninguno de los fármacos estudiados. Saquinavir potenciado: No se han llevado a cabo estudios de interacciones farmacocinéticas de estos fármacos en combinación con Invirase/ritonavir. Inhibidores no nucleosídicos de la transcriptasa inversa (INNTI): Delavirdina: Saquinavir no potenciado: La coadministración de delavirdina e Invirase se tradujo en un aumento del ABC de saquinavir del 348%. En la actualidad, son pocos los datos disponibles sobre la toxicidad de esta combinación, y no se conoce ninguno sobre su eficacia. En un pequeño estudio preliminar se observaron elevaciones de las enzimas hepáticas en el 13% de los sujetos durante las primeras semanas de biterapia con delavirdina y saquinavir (en el 6% fueron de grados 3 o 4). Así pues, si se prescribe esta combinación, deben vigilarse con frecuencia las pruebas funcionales hepáticas. Saquinavir potenciado: No se ha estudiado la interacción farmacológica entre Invirase/ritonavir y la delavirdina. Efavirenz: Saquinavir no potenciado: Tras la coadministración a 12 sujetos de efavirenz (600 mg) y saquinavir en cápsulas de gelatina blanda (1.200 mg tres veces al día), disminuyeron el ABC y la Cmáx de saquinavir en un 62% y un 50%, respectivamente. La concentración de efavirenz también se redujo cerca de un 10%, lo que no pareció revestir importancia clínica. Teniendo en cuenta estos resultados, saquinavir debería combinarse con efavirenz sólo si las concentraciones plasmáticas de saquinavir aumentan al añadir otros antirretrovíricos como ritonavir. Saquinavir potenciado: En un estudio con 24 voluntarios sanos que recibieron saquinavir en cápsulas de gelatina blanda/ritonavir/efavirenz en dosis de 1.600/200/600 mg al día, no se notificaron alteraciones clínicamente relevantes de las concentraciones de saquinavir y efavirenz. En otros dos estudios en pacientes infectados por el VIH se evaluó el efecto de la administración concomitante de efavirenz con un tratamiento potenciado dos veces al día (1.000/100 mg de Invirase/ritonavir dos veces al día) (n = 32), o bien con un tratamiento potenciado una vez al día (1.200/100 mg de saquinavir en cápsulas de gelatina blanda/ritonavir una vez al día) (n = 35); en ninguno de estos estudios se observó una alteración clínicamente significativa de las concentraciones de saquinavir y efavirenz. Nevirapina: Saquinavir no potenciado: La coadministración de nevirapina e Invirase dio lugar a un descenso del 24% del ABC del saquinavir, sin alteración del ABC de la nevirapina. Este descenso no parece ser clínicamente importante, por lo que no se considera necesario ajustar la dosis de ninguno de estos fármacos. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y la nevirapina. Inhibidores de la proteasa del VIH: Fosamprenavir: Saquinavir potenciado: La administración concomitante de fosamprenavir y 1.000/100 mg de Invirase/ritonavir no tuvo ningún efecto clínico significativo en la exposición al saquinavir. En 18 pacientes infectados por el VIH y tratados con 1.000/100 mg de Invirase/ritonavir y 700 mg de fosamprenavir dos veces al día, los valores del ABC y de la Cmáx del saquinavir fueron un 15% y un 9% más bajos que los observados con la combinación de saquinavir/ritonavir solo. La Cmín de saquinavir se mantuvo por encima del umbral diana para un tratamiento eficaz (descenso del 24% de 508 a 386 ng/ml). Cuando se administra Invirase/ritonavir en combinación con fosamprenavir, no es necesario ningún ajuste posológico. Indinavir: Saquinavir no potenciado: La coadministración de indinavir (800 mg tres veces al día) y una dosis única de Invirase o saquinavir en cápsulas de gelatina blanda (600-1.200 mg) en seis voluntarios sanos se tradujo en un aumento del ABC0-24h de saquinavir de 4,6-7,2 veces. Las concentraciones plasmáticas de indinavir no experimentaron cambios. En la actualidad, no se dispone de datos de la toxicología ni de la eficacia de esta combinación. No se considera necesario ajustar la dosis de ninguno de ambos fármacos ni se han determinado las dosis apropiadas de esta combinación. Saquinavir potenciado: La administración de pequeñas dosis de ritonavir aumenta las concentraciones de indinavir y podría causar nefrolitiasis. Lopinavir/ritonavir: Saquinavir potenciado: Se ha estudiado la farmacocinética del saquinavir, el ritonavir y el lopinavir en pacientes infectados por el VIH y tratados con 1.000/100 mg de saquinavir (cápsulas de gelatina blanda)/ritonavir dos veces al día en combinación con 2 o 3 INTI (n = 32), o bien con 1.000 mg de saquinavir (cápsulas de gelatina blanda) dos veces al día y la combinación fija de lopinavir/ritonavir en una dosis de 400/100 mg dos veces al día (n = 45). El lopinavir no alteró la farmacocinética del saquinavir potenciado. En pacientes tratados con y sin lopinavir se registraron, respectivamente, los siguientes valores de saquinavir: ABC0-12h en estado de equilibrio: 15.130 y 16.977 ng·h/ml; Cmáx: 2.410 y 2.300 ng/ml; Cmín: 427 y 543 ng/ml. La exposición al ritonavir fue significativamente inferior en los pacientes tratados con lopinavir, pero su eficacia como compuesto de refuerzo no varió. No parece que la combinación de lopinavir/ritonavir con saquinavir afecte a la concentración de lopinavir, según los datos de una comparación histórica con la combinación sola de lopinavir/ritonavir. No es necesario ningún ajuste posológico cuando se administra Invirase/ritonavir en combinación con lopinavir. Se debe usar lopinavir/ritonavir con precaución, dado que pueden producirse efectos aditivos sobre la prolongación del intervalo QT, el intervalo PR o ambos con Invirase/ritonavir (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Nelfinavir: Saquinavir potenciado: En 12 pacientes infectados por el VIH se ha evaluado el efecto de dosis múltiples de Invirase/ritonavir (1.000 mg de saquinavir/100 mg de ritonavir dos veces al día) en la farmacocinética en estado de equilibrio del nelfinavir (1.250 mg dos veces al día). El cociente de la media geométrica del ABC0-12h y la Cmáx de nelfinavir en presencia y ausencia de saquinavir/ritonavir era, respectivamente, de 0,94 (intervalo de confianza [IC] del 90%: 0,72-1,22) y 0,95 (IC del 90%: 0,77-1,16). El ABC0-12h y la Cmáx del metabolito M8 del nelfinavir aumentaron, respectivamente, 2,25 veces (IC del 90%: 1,47-3,44) y 1,74 veces (IC del 90%: 1,25-2,40) en presencia de saquinavir/ritonavir, pero no alteraron el perfil de seguridad del nelfinavir. En 12 pacientes infectados por el VIH se ha evaluado el efecto de dosis múltiples de nelfinavir (1.250 mg dos veces al día) en la farmacocinética en estado de equilibrio de Invirase/ritonavir (1.000 mg de saquinavir/100 mg de ritonavir dos veces al día). El cociente de la media geométrica del ABC0-12h y la Cmáx de saquinavir en presencia y ausencia de nelfinavir era, respectivamente, de 1,13 (IC del 90%: 0,73-1,74) y 1,09 (IC del 90%: 0,73-1,61). La co-administración de nelfinavir y saquinavir/ritonavir conduce a cambios impredecibles en las concentraciones de ambos fármacos. No está claro si las mayores concentraciones de M8 están asociadas con un beneficio clínico. El tratamiento de nelfinavir y saquinarvir/ritonavir fue bien tolerado. El evento adverso más frecuentemente reportado fue diarrea de leve a moderada. Saquinvir no potenciado: tras administrar a 14 pacientes infectados por VIH, una dosis única de 1200 mg de saquinavir en el cuarto día de tratamiento con nelfinavir en dosis repetidas (tres dosis diarias de 750mg), el ABC y la Cmáx de saquinavir fueron, respectivamente, un 392% y un 179% mayores que con saquinavir en monoterapia. Después de administrar a los mismos pacientes una dosis única de 750mg de nelfinavir en el cuarto diaa de tratamiento con saquinvir en dosis repetidas (tre dosis diarias de 1200 mg), el ABC de nelfinavir fue un 18% mayor que tras su administración en monoterapia; la Cmáx no varió. La cuatriterapia con Fortovase, nelfinavir y dos INTI produjo una respuesta más duradera que la triterapia con cualquiera de los IP. La tolerabilidad de los regímenes fue, en general, buena. Ahora bien, la coadministración de nelfinavir y saquinavir dio lugar a un aumento moderado de la incidencia a diarrea. Ritonavir: No se han observado cambios farmacocinéticos del ritonavir en voluntarios sanos tras la administración oral de saquinavir en dosis únicas o múltiples. El ritonavir inhibe intensamente el metabolismo del saquinavir, lo que se traduce en un considerable aumento de las concentraciones plasmáticas de saquinavir. Los valores de ABC0-24h y Cmáx de saquinavir en estado de equilibrio en 10 pacientes tratados con Invirase en dosis de 600 mg tres veces al día fueron, respectivamente, de 2.598 ng·h/ml y 197 ng/ml. Con Invirase en dosis de 1.000 mg dos veces al día en combinación con 100 mg de ritonavir dos veces al día, las concentraciones plasmáticas de saquinavir en equilibrio (n = 24) fueron las siguientes: ABC0-24h = 29.214 ng·h/ml; Cmáx = 2.623 ng/ml, y Cmín = 371 ng/ml. En los pacientes infectados por el VIH, la biterapia con saquinavir en cápsulas de gelatina blanda o Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día proporciona una exposición sistémica al saquinavir durante 24 horas similar o superior a la obtenida con 1.200 mg tres veces al día de saquinavir en cápsulas de gelatina blanda en monoterapia (ver Propiedades farmacocinéticas). Tipranavir: En un estudio clínico de un régimen politerápico de refuerzo doble con inhibidores de la proteasa en pacientes adultos VIH positivos con múltiples tratamientos anteriores, el tipranavir coadministrado con una dosis baja de ritonavir redujo en un 78% la Cmín de saquinavir. Por tanto, no se recomienda la administración concomitante de tripanavir, junto con una dosis baja de ritonavir, y saquinavir/ritonavir, ya que se desconoce la importancia clínica de esta reducción. Ahora bien, si se considera necesaria esta combinación, es muy importante vigilar la concentración plasmática de saquinavir. Inhibidores de la fusión del VIH: Enfuvirtida: Saquinavir potenciado: No se observó ninguna interacción clínicamente significativa en un estudio tras la administración a 12 pacientes infectados por el VIH de enfuvirtida junto con saquinavir en cápsulas de gelatina blanda/ritonavir en dosis de 1.000/100 mg dos veces al día. Saquinavir no potenciado: No se ha estudiado la interacción de la enfuvirtida y el saquinavir administrado sin ritonavir. Otros medicamentos: Antiarrítmicos: Bepridil, lidocaína sistémica, quinidina: En combinación con Invirase/ritonavir, las concentraciones de estos antiarrítmicos pueden incrementarse. Está contraindicada la asociación de estos antiarrítmicos con Invirase/ritonavir debido a la posibilidad de que se produzca una arritmia cardíaca potencialmente mortal (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Anticoagulantes: Warfarina: Las concentraciones de warfarina pueden verse alteradas. En caso de administración conjunta de warfarina e Invirase/ritonavir, se recomienda vigilar el índice internacional normalizado (INR). Anticonvulsionantes: Carbamazepina, fenobarbital, fenitoína: Estos fármacos inducen la actividad de CYP3A4 y podrían reducir la concentración de saquinavir si se administra Invirase no potenciado. No se han realizado estudios de interacción entre Invirase/ritonavir y estos fármacos. Antidepresivos: Antidepresivos tricíclicos (por ejemplo: amitriptilina, imipramina): Invirase/ritonavir podría aumentar la concentración de los antidepresivos tricíclicos. Se recomienda vigilar la concentración terapéutica cuando se administren antidepresivos tricíclicos en combinación con Invirase/ritonavir. Nefazodona: Al inhibir la actividad de CYP3A4, la nefazodona podría incrementar la concentración de saquinavir. En caso de administración conjunta de nefazodona y saquinavir, se recomienda vigilar el posible desarrollo de toxicidad por saquinavir. Trazodona: El uso concomitante de trazodona e Invirase/ritonavir puede elevar la concentración plasmática de trazodona. Tras la administración de trazodona y ritonavir se han observado náuseas, mareo, hipotensión y síncope. Está contraindicada la asociación de trazodona con Invirase/ritonavir debido a la posibilidad de que se produzca una arritmia cardíaca potencialmente mortal (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Antihistamínicos: Terfenadina, astemizol: La coadministración de terfenadina y saquinavir no potenciado en cápsulas de gelatina blanda da lugar a un aumento de la exposición plasmática a la terfenadina (ABC) asociado con una prolongación del intervalo QTc. Por ello, la terfenadina está contraindicada en pacientes tratados con Invirase/ritonavir. Invirase/ritonavir no debe administrarse junto con astemizol ya que es probable que se produzcan interacciones similares (ver Contraindicaciones). Antiinfecciosos: Claritromicina: Saquinavir no potenciado: Tras administrar simultáneamente a 12 voluntarios sanos claritromicina (500 mg dos veces al día) y saquinavir en cápsulas de gelatina blanda (1.200 mg tres veces al día), el ABC y la Cmáx de saquinavir en estado de equilibrio fueron, respectivamente, un 177% y un 187% mayores que los valores obtenidos con saquinavir en monoterapia. El ABC y la Cmáx de claritromicina fueron aproximadamente un 40% mayores que las de ésta en monoterapia. La coadministración de ambos fármacos durante un período limitado y en las dosis estudiadas no requiere ningún ajuste posológico. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y la claritromicina. Eritromicina: Saquinavir no potenciado: Tras administrar simultáneamente eritromicina (250 mg cuatro veces al día) y saquinavir en cápsulas de gelatina blanda (1.200 mg tres veces al día) a 22 pacientes infectados por el VIH, el ABC y la Cmáx de saquinavir en estado de equilibrio fueron, respectivamente, un 99% y 106% mayores que los valores obtenidos con saquinavir en monoterapia. La coadministración de ambos fármacos no requiere ningún ajuste posológico. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y la eritromicina. Se debe usar la eritromicina con precaución, dado que pueden producirse efectos aditivos sobre la prolongación del intervalo QT, el intervalo PR o ambos con Invirase potenciado con ritonavir (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Antibióticos estreptogramínicos como quinupristina y dalfopristina: Al inhibir la actividad de CYP3A4, podrían incrementar la concentración de saquinavir tras la administración de Invirase/ritonavir. En caso de coadministración de estos fármacos y saquinavir, se recomienda vigilar el posible desarrollo de reacciones adversas al saquinavir. Antifúngicos: Ketoconazol: Saquinavir no potenciado: Tras la coadministración de ketoconazol (una dosis diaria de 200 mg) e Invirase, las concentraciones plasmáticas de saquinavir fueron 1,5 veces mayores, sin que aumentara la semivida de eliminación ni la velocidad de absorción. La farmacocinética del ketoconazol no se vio afectada por la coadministración de saquinavir en dosis de 600 mg tres veces al día. No es preciso ajustar la dosis de ninguno de estos medicamentos cuando se administran conjuntamente en las dosis estudiadas. Saquinavir potenciado: Los datos de un estudio de interacción farmacológica con 200 mg al día de ketoconazol e Invirase/ritonavir (1.000 mg de saquinavir/100 mg de ritonavir dos veces al día) en 20 sujetos sanos mostraban que no habían variado la Cmáx ni el ABC0-12h de saquinavir ni de ritonavir en estado de equilibrio. Por consiguiente, no es necesario ajustar las dosis de saquinavir ni de ritonavir cuando se coadministren con ≤ 200 mg de ketoconazol. El efecto de Invirase/ritonavir (1.000 mg de saquinavir/100 mg de ritonavir dos veces al día) en la farmacocinética del ketoconazol (200 mg al día) se ha estudiado en 12 sujetos sanos. La Cmáx y el ABC0-24 h de ketoconazol en estado de equilibrio se elevó, respectivamente, en un 45% (IC del 90%: 32%-59%) y un 168% (IC del 90%: 146%- 193%) en presencia de Invirase/ritonavir (1.000 mg de saquinavir/100 mg de ritonavir dos veces al día). Estos resultados deben tenerse en cuenta cuando se administre ketoconazol con saquinavir/ritonavir. Por consiguiente, no se recomienda administrar dosis altas de ketoconazol ( > 200 mg al día). Itraconazol: Saquinavir no potenciado: Al igual que el ketoconazol, el itraconazol inhibe moderadamente a CYP3A4 y puede causar una interacción de magnitud similar. Si se administra itraconazol junto con saquinavir, se recomienda vigilar el posible desarrollo de reacciones adversas al saquinavir. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y el itraconazol. Fluconazol/miconazol: El fluconazol y el miconazol, inhibidores de CYP3A4, pueden incrementar las concentraciones plasmáticas de saquinavir. No se han llevado a cabo estudios específicos de interacción con ninguno de estos fármacos. Antimicobacterianos: Rifabutina: Saquinavir no potenciado: La rifabutina disminuye las concentraciones plasmáticas de saquinavir en un 40%. No se deben administrar simultáneamente rifabutina e Invirase no potenciado (ver Advertencias). Saquinavir potenciado: En 25 voluntarios sanos se evaluó el efecto de dosis múltiples de rifabutina sobre la farmacocinética de Invirase/ritonavir en una dosis de 1.000/100 mg dos veces al día. La rifabutina pareció reducir ligeramente el ABC0-12h y la Cmáx de saquinavir en un 13% (IC del 90%: -31% a 9%) y un 15% (IC del 90%: -32% a 7%), respectivamente, en los voluntarios sanos tratados con 150 mg de rifabutina una vez cada tres días más 1.000/100 mg de Invirase/ritonavir dos veces al día. No se observó ningún efecto de la rifabutina en el ABC0-12h (IC del 90%: -10% a 9%) y la Cmáx (IC del 90%: - 8% a 7%) del ritonavir. No es necesario ningún ajuste posológico de saquinavir/ritonavir en dosis de 1.000/100 mg dos veces al día cuando se administre Invirase/ritonavir en combinación con rifabutina. En dos grupos de voluntarios sanos se evaluó el efecto de Invirase/ritonavir en una dosis de 1.000/100 mg dos veces al día sobre la farmacocinética de la rifabutina. En el primer grupo (n = 14) se coadministró rifabutina en dosis de 150 mg cada tres días con Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día; el ABC0-72h y la Cmáx de la fracción activa (rifabutina + 25-O-desacetil-rifabutina) se elevaron en un 134% (IC del 90%: 109%-162%) y un 130% (IC del 90%: 98%-167%), respectivamente, en comparación con los valores obtenidos cuando la rifabutina se administró sola en una dosis de 150 mg diarios. La exposición a la rifabutina aumentó en un 53% (IC del 90%: 36%-73%) según el ABC0-72h y un 86% (IC del 90%: 57%-119%) según la Cmáx. En el segundo grupo (n = 13) se coadministró rifabutina en dosis de 150 mg cada cuatro días con Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día; el ABC0-96h y la Cmáx de la fracción activa se elevaron en un 60% (IC del 90%: 43%-79%) y un 111% (IC del 90%: 75%-153%), respectivamente, en comparación con los valores obtenidos cuando la rifabutina se administró sola en dosis de 150 mg diarios. En este segundo grupo, la exposición a la rifabutina no se vio afectada en el caso del ABC0-96h (IC del 90%: -10% a 13%) y la Cmáx se elevó en un 68% (IC del 90%: 38% a 105%). La seguridad y la eficacia del uso concomitante de rifabutina e Invirase/ritonavir en el tratamiento/la prevención de la tuberculosis/enfermedad por el complejo Mycobacterium avium han de ponerse en relación con los informes en la literatura especializa según los cuales la frecuencia de la administración podría no ser adecuada para prevenir la resistencia a la rifabutina en los pacientes infectados por el VIH (a diferencia de los voluntarios sanos). Los cálculos y las predicciones para inhibidores de la proteasa potenciados con ritonavir, incluidos Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día en combinación con rifabutina en una dosis de 150 mg cada tres o cuatro días, se han ajustado a una dosis de rifabutina de 150 mg cada dos días. Las predicciones sobre concentraciones sanguíneas para Invirase/ritonavir eran aproximadamente iguales que para los otros inhibidores de la proteasa potenciados con ritonavir (darunavir, lopinavir, fosamprenavir). Por consiguiente, la dosis recomendada de rifabutina es de 150 mg cada dos días cuando se utilice en combinación con Invirase/ritonavir (1.000/100 mg dos veces al día). Se recomienda vigilar la neutrocitopenia y la concentración de las enzimas hepáticas en los pacientes tratados con rifabutina (150 mg cada dos días) e Invirase/ritonavir (1.000/100 mg dos veces al día). Rifampicina: Saquinavir no potenciado: Se ha demostrado que la rifampicina (dosis diaria de 600 mg) disminuye en un 80% las concentraciones plasmáticas de saquinavir. Dado que este efecto puede conducir a concentraciones subterapéuticas de saquinavir, no deben administrarse simultáneamente rifampicina e Invirase no potenciado (ver Advertencias). Saquinavir potenciado: En un estudio con 20 pacientes infectados por el VIH y con tuberculosis que recibieron 1.600 mg de saquinavir en cápsulas de gelatina blanda más 200 mg de ritonavir al día, se demostró que la rifampicina reduce el ABC de saquinavir en un 50% aproximadamente. Sin embargo, las concentraciones observadas de saquinavir se mantenían por lo general dentro del intervalo terapéutico. En dos pacientes con VIH y tuberculosis tratados con 1.000 mg de Invirase más 100 mg de ritonavir dos veces al día y 450 mg diarios de rifampicina, o bien con 400 mg de Invirase más 400 mg de ritonavir dos veces al día y 600 mg diarios de rifampicina, las concentraciones de saquinavir se mantuvieron dentro del intervalo terapéutico. En un estudio de fase I aleatorizado, abierto y con dosis múltiples que se llevó a cabo en 28 voluntarios sanos, 11 de 17 (65%) sujetos expuestos simultáneamente a 600 mg de rifampicina una vez al día y 1.000 mg de Invirase/100 mg de ritonavir dos veces al día (Invirase/ritonavir) desarrollaron toxicidad hepatocelular grave durante los 28 días del estudio (ver Ensayos clínicos). Por consiguiente, la rifampicina no debe administrarse concomitantemente a pacientes que estén tomando Invirase/ritonavir como parte de un régimen antirretrovírico (ver Contraindicaciones). Benzodiazepinas: Alprazolam, clorazepato, diazepam, flurazepam: Las concentraciones de estos fármacos pueden aumentar si se coadministran con Invirase/ritonavir. Se supervisará estrechamente la aparición de efectos sedantes en los pacientes, puesto que podría ser necesario reducir la dosis de la benzodiazepina. Midazolam: Saquinavir no potenciado: En un estudio cruzado y con doble enmascaramiento (doble-ciego), tras la coadministración a 12 voluntarios sanos de midazolam en una dosis oral única de 7,5 mg después de 3 o 5 días de tratamiento con saquinavir en cápsulas de gelatina blanda (1.200 mg tres veces al día), la CmáxUB> y el ABC aumentaron un 235% y un 514%, respectivamente. El saquinavir aumentó la semivida de eliminación del midazolam oral de 4,3 h a 10,9 h, y la biodisponibilidad absoluta, del 41% al 90%. Los sujetos experimentaron una alteración de la psicomotricidad y un aumento de la sedación. Cuando se utilizó junto con midazolam por vía intravenosa (0,05 mg/kg), saquinavir en cápsulas de gelatina blanda redujo el aclaramiento del midazolam en un 56% y alargó su semivida de eliminación de 4,1 a 9,5 h; sin embargo, sólo aumentaron las sensaciones subjetivas de los efectos farmacológicos. Saquinavir potenciado: En un estudio cruzado, tras la coadministración a 16 voluntarios sanos de midazolam en una dosis oral única de 7,5 mg después de 2 semanas de tratamiento con Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día, la Cmáx y el ABC de midazolam aumentaron 4,3 y 12,4 veces, respectivamente. Con Invirase/ritonavir se elevó la semivida de eliminación del midazolam oral de 4,7 a 14,9 h. Por consiguiente, está contraindicada la coadministración de Invirase/ritonavir con midazolam oral (ver Contraindicaciones) y debe procederse con precaución especial cuando se coadministren Invirase y midazolam parenteral. No se dispone de datos sobre el uso simultáneo de saquinavir/ritonavir y midazolam intravenoso; estudios de otros moduladores de CYP3A y midazolam intravenoso apuntan a un posible aumento de la concentración plasmática de midazolam entre 3 y 4 veces. La coadministración de Invirase y midazolam parenteral debe realizarse en una Unidad de cuidados intensivos o un entorno similar que permita una estrecha vigilancia clínica y un tratamiento médico adecuado en caso de depresión respiratoria o sedación prolongada. Se considerará el ajuste posológico, sobre todo si se administra más de una dosis única de midazolam. Inhibidores de los canales de calcio: Felodipino, nifedipino, nicardipino, diltiazem, nimodipino, verapamilo, amlodipino, nisoldipino, isradipino: Las concentraciones de estos fármacos pueden aumentar si se administran con Invirase/ritonavir. Han de tomarse precauciones y se recomienda realizar un seguimiento clínico de los pacientes. Corticosteroides: Dexametasona: Al inducir la isoenzima CYP3A4 del citocromo, puede hacer que disminuyan las concentraciones de saquinavir, por lo que ha de utilizarse con precaución. El saquinavir puede ser menos eficaz en los pacientes tratados simultáneamente con estos fármacos. No se han realizado estudios de interacción entre Invirase/ritonavir y la dexametasona. Fluticasona y budesonida: Cuando alguno de estos fármacos se ha administrado por inhalación oral o aplicación intranasal con pequeñas dosis de ritonavir, se ha notificado exposición sistémica a la fluticasona o a la budesonida. En la literatura médica se recogen varios casos de enfermedad de Cushing asociada a esta interacción. Debería considerarse la posibilidad de cambiar la medicación de los sujetos que necesiten corticosteroides inhalados/intranasales por beclometasona. Glucósidos digitálicos: Digoxina: En un estudio cruzado, tras la coadministración a 16 voluntarios sanos de digoxina en una dosis oral única de 0,5 mg después de 2 semanas de tratamiento con Invirase/ritonavir en dosis de 1.000/100 mg dos veces al día, la Cmáx y el ABC0-72h de la digoxina aumentaron en un 27% y un 49%, respectivamente. La coadministración de Invirase/ritonavir y digoxina exige especial cautela: la dosis de digoxina debe reducirse y se vigilará la concentración sérica de digoxina (ver Advertencias). Derivados ergóticos: Dihidroergotamina, ergometrina, ergotamina, metilergometrina: Invirase/ritonavir está contraindicado en combinación con derivados ergóticos debido a la posibilidad de toxicidad ergótica aguda (ver Contraindicaciones). Estimulantes de la motilidad intestinal: Cisaprida: La coadministración de cisaprida e Invirase/ritonavir puede traducirse en un aumento de la exposición a la cisaprida (ABC) asociado a la prolongación del intervalo QTc. Así pues, está contraindicada la asociación de cisaprida en pacientes que reciben Invirase/ritonavir debido a la posibilidad de que se produzcan arritmias cardíacas potencialmente mortales (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Antagonistas de los receptores H2 de la histamina: Ranitidina: Saquinavir no potenciado: En comparación con Invirase administrado solo en presencia de alimentos, la exposición al saquinavir se incrementó cuando se administró Invirase en presencia de ranitidina y de alimentos: los valores del ABC del saquinavir aumentaron un 67%. Se considera que este aumento no es clínicamente relevante y no se recomienda ajustar la dosis de saquinavir. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y la ranitidina. Inhibidores de la HMG-CoA reductasa: Atorvastatina, cerivastatina: Su metabolismo depende menos de la isoenzima CYP3A4 del citocromo. En combinación con Invirase/ritonavir, debe administrarse la dosis mínima de atorvastatina y cerivastatina, y se vigilará estrechamente la aparición de signos o síntomas de miopatía en el paciente (debilidad muscular, dolor muscular, concentraciones plasmáticas crecientes de la creatina-cinasa). Pravastatina, fluvastatina: No se metabolizan a través de CYP3A4, por lo que no se espera que interactúen con los inhibidores de la proteasa, como el ritonavir. En caso de estar indicado el tratamiento con un inhibidor de la HMG-CoA reductasa, se recomienda el uso de la pravastatina o la fluvastatina. Simvastatina, lovastatina: Su metabolismo es muy dependiente de CYP3A4, por lo que sus concentraciones plasmáticas se incrementan notablemente cuando se administran con Invirase/ritonavir. Las concentraciones altas de simvastatina y lovastatina se han asociado con rabdomiólisis. El uso de estos fármacos está contraindicado en combinación con Invirase/ritonavir. Inmunodepresores: Ciclosporina, tacrolimús, rapamicina: Sus concentraciones podrían aumentar si se coadministran con Invirase/ritonavir. Se recomienda vigilar regularmente la concentración terapéutica de los inmunodepresores cuando se administren junto con Invirase/ritonavir. Analgésicos narcóticos: Metadona: La coadministración de 1.000/100 mg de saquinavir/ritonavir dos veces al día y 60-120 mg de metadona una vez al día a 12 pacientes seronegativos para el VIH en tratamiento de mantenimiento con metadona se tradujo en un descenso del 19% del ABC de la metadona. Ninguno de los pacientes de este estudio experimentó síntomas de abstinencia. No es preciso hacer ningún ajuste posológico cuando se administra saquinavir/ritonavir en combinación con metadona. Se la debe usar con precaución, dado que pueden producirse efectos aditivos sobre la prolongación del intervalo QT, el intervalo PR o ambos al administrarla con Invirase/ritonavir (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Neurolépticos: Pimozida: La coadministración de pimozida e Invirase/ritonavir puede causar un aumento de la exposición a la pimozida (ABC) asociado a efectos aditivos en la prolongación del intervalo QT, del intervalo PR o de ambos (ver Contraindicaciones y Anomalías de la conducción cardíaca en Advertencias). Así pues, la pimozida está contraindicada en pacientes que reciben Invirase/ritonavir (ver Contraindicaciones). Anticonceptivos orales: Etinilestradiol: La concentración de etinilestradiol podría disminuir cuando se administra junto con Invirase/ritonavir. Deberían utilizarse métodos anticonceptivos alternativos o adicionales cuando se administren simultáneamente anticonceptivos orales estrogénicos e Invirase/ritonavir. Inhibidores de la fosfodiesterasa de tipo 5 (PDE5): Sildenafilo: La coadministración de saquinavir en cápsulas de gelatina blanda en estado de equilibrio (1.200 mg tres veces al día) y sildenafilo (dosis única de 100 mg), un sustrato de CYP3A4, se tradujo en un aumento de la Cmáx y del ABC de sildenafilo del 140% y el 210%, respectivamente. El sildenafilo no tuvo efecto alguno sobre la farmacocinética del saquinavir. Cuando se coadministra con Invirase/ritonavir, el sildenafilo ha de utilizarse con precaución en dosis reducidas de hasta 25 mg cada 48 horas, poniendo especial atención al posible desarrollo de acontecimientos adversos. Tadalafilo: La concentración de tadalafilo puede aumentar cuando se administra junto con Invirase/ritonavir. Cuando se coadministra con Invirase/ritonavir, el tadalafilo ha de utilizarse con precaución en dosis reducidas de hasta 10 mg cada 72 horas, prestando especial atención a la posible aparición de acontecimientos adversos. Vardenafilo: Las concentraciones de vardenafilo pueden incrementarse cuando se administra junto con Invirase/ritonavir. Cuando se coadministra con Invirase/ritonavir, el vardenafilo ha de utilizarse con precaución en dosis reducidas de hasta 2,5 mg cada 72 horas, poniendo especial atención al posible desarrollo de acontecimientos adversos. Inhibidores de la bomba de protones: Tras la coadministración de omeprazol (40 mg al día) e Invirase/ritonavir (1.000/100 mg dos veces al día) a 18 voluntarios sanos, los valores del ABC y de la Cmáx de saquinavir en estado de equilibrio fueron, respectivamente, un 82% (IC del 90%: 44%-131%) y un 75% (IC del 90%: 38%-123%) superiores a los obtenidos con Invirase/ritonavir solo. La concentración plasmática del ritonavir no cambió significativamente tras la administración de omeprazol. No se dispone de datos sobre la coadministración de Invirase/ritonavir y otros inhibidores de la bomba de protones. Si se toma omeprazol u otros inhibidores de la bomba de protones junto con Invirase/ritonavir, conviene vigilar si se produce alguna reacción adversa del saquinavir. Otros: Zumo de pomelo (toronja): Saquinavir no potenciado: En voluntarios sanos, la toma conjunta de Invirase y zumo de pomelo se tradujo en un aumento de la exposición al saquinavir del 50% y el 100% con zumo de concentración normal y de concentración doble, respectivamente. Este aumento no parece ser clínicamente importante, por lo que no se considera necesario ajustar la dosis de saquinavir. Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y el zumo de pomelo. Cápsulas de ajo: Saquinavir no potenciado: La administración conjunta a 9 voluntarios sanos de cápsulas de ajo (dosis equivalente aproximadamente a 2 dientes de ajo de 4 g al día) y saquinavir en dosis de 1.200 mg tres veces al día se tradujo en una disminución del ABC de saquinavir del 51% y un descenso del 49% de la Cmín a las 8 horas de la administración. La Cmáx de saquinavir disminuyó en un 54%. Por consiguiente, los pacientes en tratamiento con saquinavir no deben tomar cápsulas de ajo ante el riesgo de descenso de las concentraciones plasmáticas y de pérdida de respuesta virológica, así como de resistencia a alguno de los componentes del régimen antirretrovírico (ver Advertencias). Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir y las cápsulas de ajo. Hypericum perforatum: Saquinavir no potenciado: Algunos productos herbarios tienen también componentes que inhiben o inducen la isoenzima CYP3A4 del citocromo o la glucoproteína P y, por consiguiente, pueden afectar a la farmacocinética del saquinavir. No deben tomarse productos herbarios que contengan Hypericum perforatum (hipérico, corazoncillo, hierba de San Juan) durante el tratamiento con Invirase, pues existe el riesgo de disminución de la concentración plasmática y de pérdida de respuesta virológica, así como de resistencia a alguno de los componentes del régimen antirretrovírico (ver Advertencias). Saquinavir potenciado: No se han realizado estudios de interacción entre Invirase/ritonavir e Hypericum perforatum. Otras interacciones posibles: Fármacos que son sustratos de CYP3A4: Aunque no se han efectuado estudios específicos, la coadministración de Invirase/ritonavir y fármacos metabolizados principalmente por la isoenzima CYP3A4 del citocromo (dapsona, disopiramida, quinina, fentanilo y alfentanilo) puede traducirse en un aumento de la concentración plasmática de estos fármacos. Por ello, este tipo de combinaciones han de administrarse con cautela (ver Contraindicaciones y Advertencias). Fármacos que son sustratos de la glucoproteína P: La coadministración de Invirase/ritonavir y fármacos que son sustratos de la glucoproteína P (por ejemplo, azitromicina) podría elevar las concentraciones plasmáticas de estos fármacos, por lo que es recomendable realizar controles de la toxicidad. Inhibidores de CYP3A4: Por otra parte, la concentración plasmática de saquinavir puede aumentar con otros compuestos inhibidores de CYP3A4, como fluconazol, itraconazol, miconazol y nefazodona. Si estos fármacos se administran con saquinavir, sería necesario vigilar la posible aparición de toxicidad por saquinavir. Inductores de CYP3A4 o de la glucoproteína P: A su vez, otros inductores de CYP3A4 también pueden reducir las concentraciones plasmáticas de saquinavir. Medicamentos que aceleran el tránsito gastrointestinal: Se desconoce si los fármacos que aceleran el tránsito gastrointestinal (por ejemplo, metoclopramida) podrían provocar una disminución de la concentración plasmática de saquinavir. Uso en poblaciones especiales: Embarazo: De los estudios realizados con animales de experimentación no se desprende que exista ningún efecto nocivo, directo o indirecto, sobre el desarrollo embrionario o fetal, la evolución del embarazo o el desarrollo perinatal o posnatal. La experiencia clínica con mujeres embarazadas es reducida, por lo que sólo se debe utilizar saquinavir durante el embarazo cuando los beneficios esperados justifiquen el posible riesgo para el feto. Lactancia: No hay datos analíticos en animales o el ser humano sobre el paso del saquinavir a la leche materna. Dado que es imposible valorar las posibles reacciones adversas del saquinavir en los lactantes, debe suspenderse la lactancia natural antes de administrar saquinavir a la madre. Los especialistas recomiendan que las mujeres infectadas por el VIH no amamanten a sus hijos en ninguna circunstancia, con el fin de evitar la transmisión del virus. Uso en pediatría: No se han determinado aún la seguridad toxicológica ni la eficacia del saquinavir en niños y adolescentes menores de 16 años infectados por el VIH. La información disponible sobre niños tratados con cápsulas de gelatina blanda de saquinavir no potenciado es reducida, y no hay datos sobre niños tratados con Invirase no potenciado. Dado que las concentraciones plasmáticas de saquinavir son significativamente menores en los niños que en los adultos, Invirase no potenciado no debe utilizarse en aquéllos. Según datos preliminares obtenidos en niños, la biterapia con cápsulas de gelatina blanda de saquinavir/ritonavir se traduce en concentraciones plasmáticas de saquinavir muy superiores a las obtenidas con cápsulas de gelatina blanda de saquinavir en monoterapia. Uso en geriatría: La experiencia con pacientes mayores de 60 años es reducida. No hay datos disponibles para establecer una recomendación posológica en pacientes ancianos. Insuficiencia renal: No es necesario ajustar la dosis en los pacientes con insuficiencia renal leve o moderada. En los pacientes con insuficiencia renal grave debe procederse con especial precaución (ver Advertencias). Insuficiencia hepática: No es necesario ajustar la dosis en los pacientes infectados por el VIH con insuficiencia hepática moderada (ver Farmacocinética en poblaciones especiales). Invirase/ritonavir está contraindicado en los pacientes con insuficiencia hepática grave (ver Contraindicaciones).
Conservación.
Este medicamento sólo deberá utilizarse hasta la fecha de caducidad, indicada con VEN en el envase. No debe conservarse a más de 30°C.
Sobredosificación.
La experiencia con la sobredosis de saquinavir es reducida. Aunque la sobredosis aguda o crónica de saquinavir en monoterapia no ha causado complicaciones importantes, en combinación con otros inhibidores de la proteasa se han observado signos y síntomas de sobredosis como debilidad general, diarrea, náuseas, vómitos, pérdida de cabello, sequedad de boca, hiponatremia, adelgazamiento e hipotensión ortostática. No se conoce ningún antídoto específico del saquinavir. En caso de sobredosis de saquinavir deben aplicarse las medidas de apoyo habituales, incluidas la vigilancia de las constantes vitales del paciente y del ECG, así como la observación de su estado clínico. Cuando esté indicada, puede considerarse la prevención de toda nueva absorción. Dado que el saquinavir se une en alto grado a las proteínas, no es probable que la diálisis contribuya a eliminar el principio activo en grado significativo.
Presentación.
Comprimidos recubiertos de 500 mg: envase con 120.

