CELSENTRI
GLAXOSMITHKLINE
Comprimidos Recubiertos de 150 mg
Antirretroviral.
Composición.
Comprimidos de 150 mg: Cada comprimido recubierto contiene 150 mg de maraviroc. Los comprimidos recubiertos de 150 mg son ovalados, biconvexos, de color azul, grabados con "MVC" en una cara y "150" en la otra. Presentación: Comprimidos recubiertos. Lista de Excipientes: Núcleo de la tableta: Celulosa microcristalina. Fosfato ácido de calcio (anhidro). Almidón glicolato de sodio. Estearato de magnesio. Recubrimiento: Alcohol polivinílico. Dióxido de titanio. Polietilén glicol (macrogol 3350). Talco. Lecitina de soya. FD&C azul No.2 laca de aluminio.
Farmacología.
Farmacodinamia: Código ATC: Grupo farmacoterapéutico: Antivirales para uso sistémico, Otros antivirales código ATC: J05AX09. Mecanismo de acción: El maraviroc es un miembro de una clase terapéutica llamada antagonistas del CCR5. El maraviroc se une selectivamente al receptor humano de quimiocina CCR5, evitando que el VIH-1 con tropismo CCR5 ingrese a las células. Efectos farmacodinámicos: Actividad antiviral en cultivos celulares: El valor CE90 en 43 aislados clínicos primarios de VIH-1 con tropismo CCR5 fue de 0,57 (0,06 - 10,7) nanogramos/mL (fracción no unida), sin cambios significativos entre los diferentes subtipos evaluados. Maraviroc no tiene actividad antiviral en cultivos celulares contra virus que puedan usar al CXCR4 como su co-receptor de ingreso (virus con tropismo dual o con tropismo CXCR4, colectivamente llamados virus 'usuarios del CXCR4' a continuación). La actividad antiviral del maraviroc contra el VIH-2 no ha sido evaluada. Cuando se usó con otros medicamentos antirretrovirales en cultivos celulares, la combinación con maraviroc no causó antagonismo con una gama de NRTIs, NNRTIs, PIs o con el inhibidor de la fusión del VIH enfuvirtida. Resistencia: El escape viral del maraviroc puede ocurrir por medio de dos rutas: la selección de virus que puedan usar al CXCR4 como su co- receptor de ingreso (virus usuarios del CXCR4) o la selección de virus que continúen usando exclusivamente al CCR5 (virus con tropismo CCR5). Resistencia en cultivos celulares: Se han seleccionado en cultivos celulares variantes del VIH-1 con susceptibilidad reducida a maraviroc, después de pasajes seriados de dos aislados virales clínicos con tropismo CCR5. Los virus resistentes al maraviroc continuaron teniendo tropismo CCR5 y no hubo una conversión de un virus con tropismo CCR5 a virus usuarios de CXCR4. Resistencia fenotípica: las curvas de concentración respuesta para los virus resistentes al maraviroc se caracterizaron por ser curvas que no alcanzaron el 100% de inhibición en ensayos usando diluciones seriales de maraviroc. El tradicional cambio en el número de veces de la CE50 no resultó un parámetro útil para medir la resistencia fenotípica, dado que dichos valores algunas veces permanecieron sin cambio a pesar de que la sensibilidad estaba significativamente reducida. Resistencia genotípica: se encontró que las mutaciones se acumulaban en la glicoproteína gp120 de la envoltura (la proteína viral que se une al co- receptor CCR5). La posición de estas mutaciones no fue consistente entre los diferentes aislados. Por lo tanto, se desconoce la importancia de estas mutaciones para la susceptibilidad al maraviroc en otros virus. Resistencia cruzada: todos los aislados clínicos de VIH-1 resistentes a los inhibidores de la transcriptasa inversa análogos de nucleósidos (NRTI), a los inhibidores de la transcriptasa inversa no análogos de nucleósidos (NNRTI), a los inhibidores de la proteasa (PI) y a la enfuvirtida fueron susceptibles al maraviroc en cultivos celulares. Los virus resistentes al maraviroc que surgieron en el cultivo celular permanecieron sensibles al inhibidor de la fusión enfuvirtida y al inhibidor de la proteasa saquinavir. In vivo: En los estudios clínicos se han observado ambas rutas hacia la resistencia tanto en pacientes que no habían recibido tratamiento como en pacientes que habían recibido tratamiento previamente. La presencia de virus usuarios de CXCR4 en la falla virológica parece originarse a partir de una población viral preexistente. Las pruebas previas a la terapia en busca de la presencia de esta forma viral pueden reducir la incidencia de falla mediante este mecanismo. En pacientes en los que fracasa la terapia, con virus R5 exclusivamente, puede considerarse que el maraviroc aún está activo si el valor de la máxima inhibición porcentual (MPI) es ≥95% (Ensayo Phenosense Entry). La actividad residual in vivo para virus con valor de MPI < 95% no se ha determinado. La resistencia de los virus R5 mediante el incremento de la CE50 no parece ser un mecanismo de fracaso importante. Resistencia genotípica: en este momento no pueden sugerirse las mutaciones clave (región V3) debido a la alta variabilidad de la secuencia V3 y al bajo número de muestras analizadas. Pacientes que ya han recibido tratamiento: En los estudios fundamentales (MOTIVATE 1 y MOTIVATE 2), 7,6% de los pacientes presentaron un cambio en el resultado de tropismo de tropismo CCR5 a tropismo CXCR4 o dual/mixto entre la exploración y el inicio (un periodo de cuatro-seis semanas). Fracaso con virus usuarios de CXCR4: En aproximadamente 55% de los sujetos en los que fracasó el tratamiento con maraviroc, se detectaron virus usuarios de CXCR4 al momento del fracaso, en comparación con 6% de sujetos que experimentaron fracaso del tratamiento en el brazo de OBT solo. Para investigar el probable origen de los virus usuarios de CXCR4 durante el tratamiento, se llevó a cabo un análisis clonal detallado en virus de 20 sujetos representativos (16 sujetos de los brazos de maraviroc y cuatro sujetos del brazo de OBT solo) en las que se había detectado virus usuarios de CXCR4. Este análisis indicó que los virus usuarios de CXCR4 surgieron de un reservorio preexistente de virus usuarios de CXCR4 que no fue detectado en el punto de partida, más que de una mutación de los virus con tropismo CCR5 presentes en el punto de partida. Un análisis de tropismo que siguió al fracaso de la terapia con maraviroc con virus usuarios de CXCR4 en pacientes con virus CCR5 al inicio, demostró que la población viral revirtió a tropismo CCR5 en 33 de 36 pacientes con más de 35 días de seguimiento. Al momento del fracaso con virus usuarios de CXCR4, el patrón de resistencia a otros antirretrovirales parece ser similar al de la población con tropismo CCR5 al inicio, con base en la información disponible. Por lo tanto en la selección del régimen de tratamiento, debe asumirse que los virus que forman parte de la población de virus usuarios de CXCR4 no detectados previamente (es decir la población viral minoritaria) albergan los mismos patrones de resistencia que la población con tropismo CCR5. Fracaso con virus con tropismo CCR5: Resistencia fenotípica: en pacientes con virus con tropismo CCR5 al momento del fracaso al tratamiento con maraviroc, 22 de 58 pacientes tenían virus con una sensibilidad reducida al maraviroc. Adicionalmente, los virus con tropismo CCR5 de 2 sujetos en los que fracasó el tratamiento tenían incrementos 3 veces en los valores de CE50 para maraviroc al momento del fracaso, pero la importancia de esto no es clara. En los pacientes restantes, no hubo evidencia de virus con una sensibilidad reducida lo cual se identificó mediante análisis biológicos exploratorios en un grupo representativo. Este último grupo tenía marcadores de baja exposición, en algunos casos asociados con una baja adherencia al tratamiento. Pacientes que no habían recibido tratamiento previo: En el estudio fundamental (MERIT), 3,8% (13/343) de pacientes presentaron un cambio en el resultado del tropismo de tropismo CCR5 a tropismo CXCR4 o dual/mixto entre la exploración y el inicio, (período de cuatro cuatro-seis semanas). Fracaso con virus usuarios de CXCR4: Se detectaron virus usuarios de CXCR4 en aproximadamente 28% (24/86) de sujetos con virus con tropismo CCR5 al inicio y en los que fracasó el tratamiento con maraviroc, en comparación con ninguno de los sujetos que experimentaron fracaso del tratamiento en el brazo de efavirenz. Con base en un re-análisis, cuando los sujetos que presentaban virus usuarios CXCR4 en la exploración, detectados usando un ensayo de tropismo con sensibilidad mejorada, fueron censurados del análisis, de los sujetos con virus con tropismo CCR5 inicialmente y en los que fracasó el tratamiento con maraviroc, se detectaron virus usuarios de CXCR4 en 21% (25/118) en comparación con ninguno en el brazo de efavirenz. Se realizó un análisis clonal detallado en dos sujetos que no habían recibido tratamiento previo con antirretrovirales enrolados en un estudio con monoterapia Fase 2a y en los que se había observado virus usuarios CXCR4 después de 10 días de tratamiento con maraviroc. En forma consistente con el análisis clonal detallado realizado en sujetos que ya habían recibido tratamiento, se encontró que la variante de virus usuarios de CXCR4 existía antes del inicio de la terapia. Fracaso con virus con tropismo CCR5: Resistencia fenotípica: en pacientes con virus con tropismo CCR5 al momento del fracaso del tratamiento con maraviroc, 6 de 38 pacientes tenían virus con una sensibilidad reducida al maraviroc. En los 32 pacientes restantes, no había evidencia de virus con sensibilidad reducida lo cual se identificó mediante ensayos virológicos exploratorios en un grupo representativo. Un sujeto adicional presentaba un incremento de ≥3 veces en el valor CE50 para maraviroc al momento del fracaso. Farmacocinética: Absorción: La absorción del maraviroc es variable y con picos múltiples. La mediana de las concentraciones plasmáticas máximas de maraviroc se obtiene a las dos horas (intervalo 0,5-4 horas) después de una dosis oral única de una tableta comercial de 300 mg administrada a voluntarios sanos. La farmacocinética del maraviroc oral no es proporcional a la dosis en el intervalo de 1-1200 mg. La biodisponibilidad absoluta de una dosis de 100 mg es de 23% y se predice que sea de 33% a 300 mg. El maraviroc es un sustrato de la glicoproteína P, un transportador de eflujo. La co-administración de una tableta de 300 mg con un desayuno alto en grasas redujo la Cmáx y el ABC del maraviroc en un 33% en voluntarios sanos. No existieron restricciones en la alimentación en los estudios que demostraron la eficacia y seguridad del maraviroc (referirse a Farmacodinamia). Por lo tanto, el maraviroc puede tomarse con o sin alimentos a las dosis recomendadas (referirse a Dosificación). Distribución: El maraviroc se une a las proteínas plasmáticas humanas (aproximadamente 76%) y muestra una afinidad moderada por la albúmina y la alfa-1 glucoproteína ácida. El volumen de distribución del maraviroc es de aproximadamente 194L. Metabolismo: Estudios con humanos y estudios in vitro usando microsomas hepáticos humanos y enzimas expresadas, han demostrado que el maraviroc se metaboliza principalmente por medio del sistema del citocromo P450 a metabolito que son esencialmente inactivos contra el VIH-1. Los estudios in vitro indican que la CYP3A es la principal enzima responsable del metabolismo del maraviroc. Los estudios in vitro también indican que las enzimas polimórficas CYP2C9, CYP2D6 y CYP2C19 no contribuyen significativamente al metabolismo del maraviroc. El maraviroc es el principal componente circulante (aproximadamente 42% de la radiactividad) después de una dosis oral única de 300 mg. El metabolitos circulante más significativo en el humano es una amina secundaria (aproximadamente 22% de la radiactividad) formada por N-desalquilación. Este metabolito polar no tiene actividad farmacológica significativa. Otros metabolitos son productos de la monooxidación y solamente son componentes menores de la radiactividad plasmática. Eliminación: Se realizó un estudio de excreción/balance de masa usando una dosis única de 300 mg de maraviroc marcado con 14C. Aproximadamente 20% de sustancia radiomarcada fue recuperado en la orina y 76% fue recuperado en las heces después de 168 horas. El maraviroc fue el principal componente presente en la orina (en promedio 8% de la dosis) y en las heces (en promedio 25% de la dosis). La cantidad restante fue excretada como metabolitos. Después de la administración intravenosa (30 mg), la vida media del maraviroc fue de 13,2 horas, 22% de la dosis se excretó sin cambio en la orina y los valores de depuración total y depuración renal fueron de 44,0 L/hora y 10,2 L/hora respectivamente. Poblaciones de pacientes especiales: Niños: No se ha establecido la farmacocinética del maraviroc en niños menores de 16 años de edad (referirse a Dosificación). Adultos mayores: Se realizó el análisis poblacional de los estudios Fase 1/2a y Fase 3 (16-65 años de edad) y no se observó un efecto de la edad. No se ha establecido la farmacocinética del maraviroc en pacientes mayores de 65 años de edad (referirse a Dosificación). Insuficiencia renal: Un estudio comparó la farmacocinética de una dosis única de 300 mg de maraviroc en sujetos con insuficiencia renal grave (depuración de creatinina < 30 mL/min, n=6) y enfermedad renal en estado terminal (ESRD) contra voluntarios sanos (n=6). La media geométrica del ABCinf (CV%) para maraviroc fue como sigue: voluntarios sanos (función renal normal) 1348,4 nanogramos·h/mL (61%); insuficiencia renal grave 4367,7 nanogramos·h/mL (52%); ESRD (dosificación después de la diálisis) 2677,4 nanogramos·h/mL (40%); y ESRD (dosificación antes de la diálisis) 2805,5 nanogramos·h/mL (45%). La C máx (CV%) fue de 335,6 nanogramos/mL (87%) en los voluntarios sanos (función renal normal); 801,2 nanogramos/mL (56%) insuficiencia renal grave; 576,7 nanogramos/mL (51%) en ESRD (dosificación después de la diálisis) y 478,5 nanogramos/mL (38%) en ESRD (dosificación antes de la diálisis). La diálisis tuvo un efecto mínimo sobre la exposición en sujetos con ESRD. Las exposiciones observadas en sujetos con insuficiencia renal grave y con ESRD se encontraron dentro del intervalo de las observadas en estudios con dosis única de 300 mg de maraviroc en voluntarios sanos con función renal normal. Por lo tanto, no es necesario un ajuste de dosis en pacientes con insuficiencia renal recibiendo maraviroc sin un inhibidor potente de la CYP3A (referirse a Dosificación, Advertencias e Interacciones). Además, el estudio comparó la farmacocinética de dosis múltiples de maraviroc en combinación con saquinavir/ritonavir 1000/100 mg dos veces al día (una combinación de inhibidores potentes de la CYP3A) durante siete días en sujetos con insuficiencia renal leve (depuración de creatinina > 50 y 80 mL/min, n=6) e insuficiencia en renal moderada (depuración de creatinina 30 y 50 mL/min, n=6) contra voluntarios sanos (n=6). Los sujetos recibieron 150 mg de maraviroc en diferentes frecuencias de dosificación (voluntarios sanos - cada 12 horas; insuficiencia renal leve - cada 24 horas; insuficiencia renal moderada - cada 48 horas). La concentración promedio (Cavg) del maraviroc a lo largo de 24 horas fue de 445,1 nanogramos/mL, 338,3 nanogramos/mL, y 223,7 nanogramos/mL para sujetos con función renal normal, insuficiencia renal leve, e insuficiencia renal moderada, respectivamente. La Cavg del maraviroc de 24-48 horas para sujetos con insuficiencia renal moderada fue baja (Cavg: 32,8 nanogramos/mL). Por lo tanto, en sujetos con insuficiencia renal moderada (y por extrapolación en insuficiencia renal grave) la frecuencia de dosificación de más de 24 horas puede resultar en una exposición inadecuada entre las 24 y 48 horas. En pacientes con insuficiencia renal recibiendo maraviroc con inhibidores potentes de la CYP3A se recomienda una dosis de 150 mg cada 24 horas (referirse a Dosificación, Advertencias e Interacciones). Insuficiencia hepática: El maraviroc se metabolizada y elimina principalmente por el hígado. Un estudio comparó la farmacocinética de una dosis única de 300 mg de maraviroc en pacientes con insuficiencia hepática (Child-Pugh Clase A, n=8), y moderada (Child-Pugh Clase B, n=8) contra sujetos sanos (n=8). El cociente de las medias geométricas para Cmáx y ABC última fueron 11% y 25% superiores respectivamente para sujetos con insuficiencia hepática leve, y 32% y 46% superiores respectivamente para sujetos con insuficiencia hepática moderada en comparación con sujetos con función hepática normal. Los efectos de la insuficiencia hepática moderada pueden haber sido subestimados debido a la limitada información en pacientes con capacidad metabólica disminuida y mayor depuración renal en estos sujetos. Por lo tanto los resultados deben ser interpretados con precaución. No se ha estudiado la farmacocinética del maraviroc en sujetos con insuficiencia hepática grave (referirse a Dosificación y Advertencias). Otras características del paciente: Raza: El análisis de la farmacocinética poblacional de información combinada Fase 1/2a indicó que la exposición fue 26,5% superior en asiáticos (n=95) en comparación con no asiáticos (n=318). Sin embargo, un estudio diseñado para evaluar la diferencia farmacocinética entre caucásicos (n=12) y asiáticos (n=12) no mostró diferencia entre estas dos poblaciones. El análisis farmacocinético poblacional de la información de todos los sujetos que recibieron maraviroc en MERIT mostró una exposición superior con significancia estadística (17,5%) en personas de raza negra (n=143) y otras razas (n=35) combinados en comparación con blancos (n=327) y asiáticos (n=10) combinados. No es necesario un ajuste de dosis en base a la raza. Sexo: el análisis farmacocinético poblacional de información combinada Fase 1/2a indica que el sexo (mujeres: n=96, 23,2% de la población total) no afecta a las concentraciones de maraviroc. No es necesario un ajuste de dosis en base al sexo. Estudios clínicos: Estudios en pacientes que ya hayan recibido tratamiento, con tropismo CCR5: Se ha investigado la eficacia clínica del maraviroc (en combinación con otros medicamentos antirretrovirales) en los niveles plasmáticos de RNA de VIH y los recuentos de células CD4+ en dos estudios fundamentales, aleatorizados, doble ciego, multicéntricos (MOTIVATE-1 y MOTIVATE-2, n=1049) en pacientes infectados con VIH-1 con tropismo CCR5 (determinado mediante el ensayo de Trofile). El criterio de valoración principal de eficacia fue a las 48 semanas. Los pacientes elegibles para estos estudios habían tenido exposición previa a al menos tres clases de medicamentos antirretrovirales [≥1 inhibidor de la transcritasa inversa análogo de nucleósido (NRTI), ≥1 inhibidor de la transcritasa inversa no análogo de nucleósido (NNRTI), ≥2 inhibidor de la proteasa (PI), y/o enfuvirtida] o resistencia documentada a al menos un miembro de cada clase. Los pacientes fueron aleatorizados en una relación 2:2:1 a maraviroc 300 mg (dosis equivalente) una vez al día, dos veces al día o placebo en combinación con una Terapia de Base Optimizada (OBT) consistente en tres a seis medicamentos antirretrovirales (excluyendo ritonavir a bajas dosis). El OBT se seleccionó en base al historial de tratamientos previos del sujeto y en las determinaciones basales de resistencia viral genotípica y fenotípica.
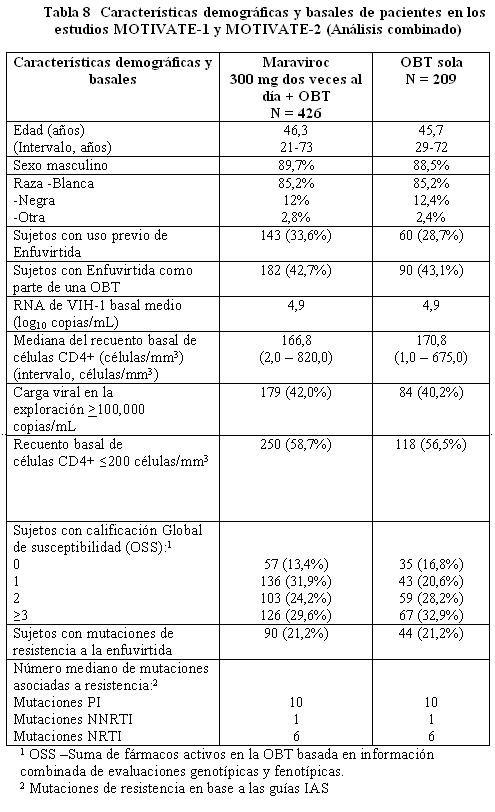
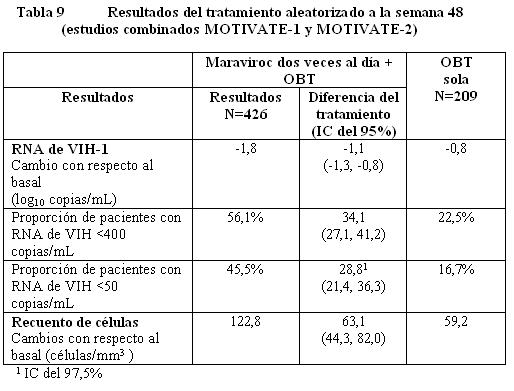
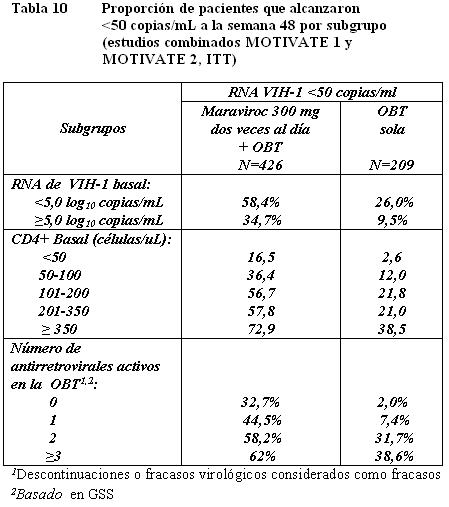
Maraviroc dos veces al día + OBT fue superior a OBT sola en todos los subgrupos de pacientes analizados (ver Tabla 10).
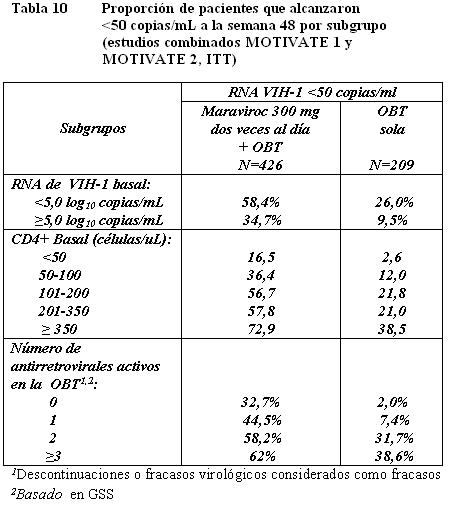
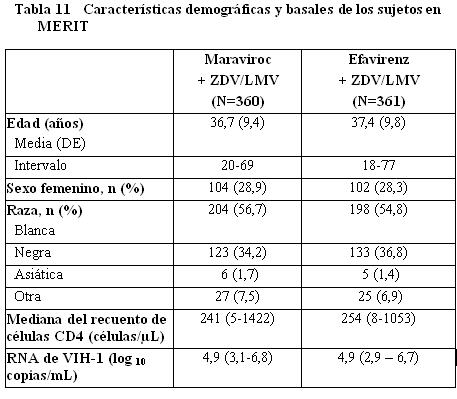
Estudios en pacientes que ya habían recibido tratamiento con tropismo No-CCR5: El estudio A4001029 fue un estudio exploratorio, multicéntrico, doble ciego, aleatorizado, para determinar la seguridad y eficacia del maraviroc en sujetos infectados con VIH-1 con tropismo/mixto o tropismo CXCR4. Los criterios de inclusión/exclusión fueron similares a los de MOTIVATE-1 y MOTIVATE-2 antes mencionados y los sujetos fueron aleatorizados en una proporción 1:1:1 a maraviroc una vez al día, maraviroc dos veces al día o placebo. No se observó incremento en el riesgo de infección o de progresión de la enfermedad por VIH en los sujetos que recibieron maraviroc. El uso de maraviroc no se asoció con una disminución significativa en el RNA de VIH-1 en comparación con placebo en estos sujetos y no se observó un efecto adverso en el recuento de CD4. Estudios en Pacientes con tropismo CCR5 que no habían recibido tratamiento previo: El estudio A4001026 (MERIT) es un estudio aleatorizado, doble ciego, multicéntrico, en sujetos infectados con VIH-1 con tropismo CCR5 clasificados mediante el ensayo de tropismo TrofileTM. Se requirió que los sujetos tuvieran RNA de VIH-1 ≥2000 copias/mL y no podían: 1) haber recibido previamente una terapia antirretroviral por > 14 días, y 2) presentar una infección oportunista activa o reciente o una sospecha de infección primaria por VIH-1, o 3) tener una resistencia fenotípica o genotípica a la zidovudina, lamivudina, o efavirenz. Los sujetos fueron aleatorizados en una proporción 1:1:1 a maraviroc 300 mg una vez al día, maraviroc 300 mg dos veces al día, o efavirenz 600 mg una vez al día, cada uno en combinación con zidovudina/lamivudina. La eficacia y seguridad del maraviroc se basa en la comparación del maraviroc dos veces al día contra efavirenz. Las características demográficas y basales de los grupos de maraviroc y efavirenz fueron comparables (ver Tabla 11). Los sujetos fueron clasificados por niveles de RNA de VIH-1 y por región geográfica. La mediana del recuento de células CD4 y el RNA de VIH-1 basal fue similar para ambos grupos de tratamiento.
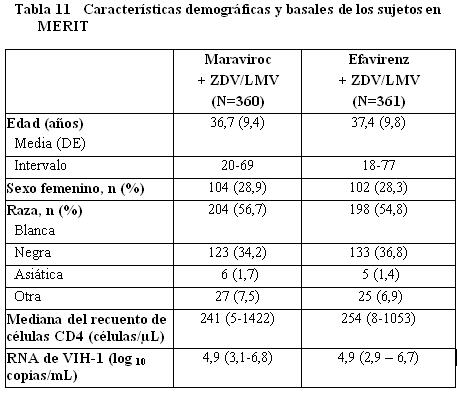
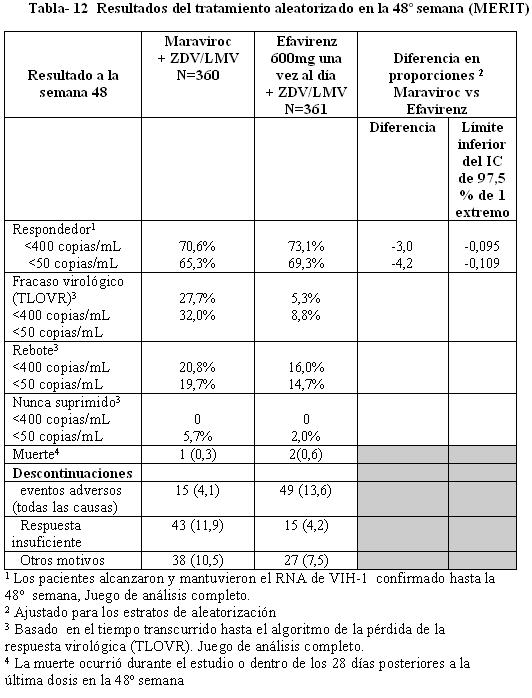
En la Tabla12 se muestran los resultados del tratamiento a la semana 48. Los criterios de valoración de eficacia principales se definieron como el porcentaje de sujetos con RNA de VIH-1 no detectable por los métodos estándar y ultrasensible ( < 400 copias/mL y < 50 copias/mL). Después de 48 semanas de terapia combinada con zidovudina/lamivudina, 300 mg de maraviroc dos veces al día demostró no inferioridad frente a 600 mg de efavirenz una vez al día en la proporción de pacientes con carga viral indetectable determinada a < 400 copias/mL pero no a < 50 copias/mL (límite inferior del IC > -10% para no inferioridad). La mediana del incremento a partir del valor basal en el recuento de células CD4+ a la semana 48 fue de 180 células /mm3 para el brazo de maraviroc en comparación con 151 células /mm3 para el brazo de efavirenz.
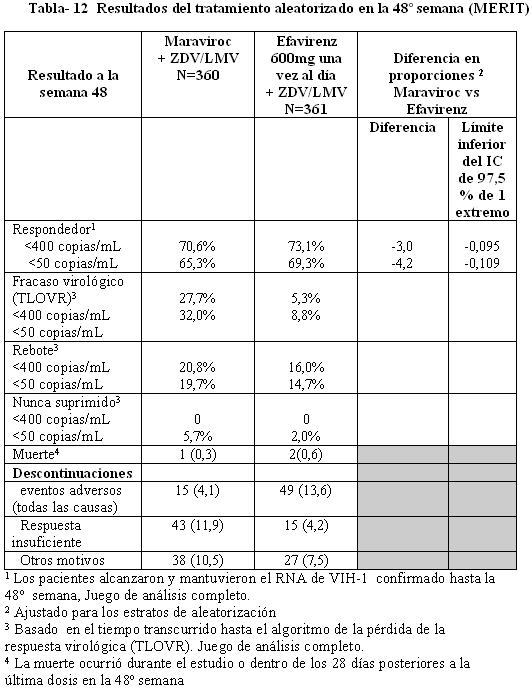
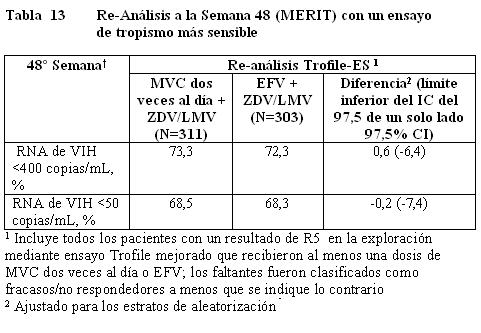
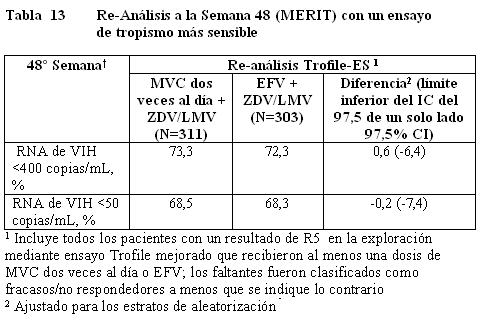
Se concluyó un re-análisis de las muestras analizadas de MERIT usando un ensayo para tropismo más sensible (Trofile-ES) el cual estuvo disponible después del análisis a la semana 48 y mostró que aproximadamente 15% de los pacientes identificados con tropismo CCR5 en el análisis primario tenían virus No-R5. La exclusión de estos pacientes tuvo como resultado que el límite inferior del intervalo de confianza del 97,5% de un solo lado para la diferencia entre tratamientos para maraviroc y efavirenz quedara por arriba de -10% para < 400 y < 50 copias/mL (ver Tabla 13).
Información preclínica: La información Preclínica no revela un peligro especial para humanos en base a estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico, o toxicidad reproductiva. Carcinogénesis/mutagénesis: Se evaluó el potencial carcinógeno del maraviroc mediante un estudio de seis meses con ratones transgénicos y un estudio de 24 meses en ratas. En ratones, el maraviroc no causó un incremento clínicamente significativo en la incidencia de cualquier tipo de tumor a exposiciones sistémicas en el intervalo de 7 a 39 veces la exposición humana (en base a la determinación del ABC0-24hr de la fracción no unida) a la dosis máxima recomendada de 300 mg dos veces al día. En ratas, la administración de maraviroc produjo adenomas tiroideos asociados con cambios adaptativos en el hígado, a una exposición sistémica de 21 veces la exposición humana con 300 mg dos veces al día. No hubo indicaciones de un potencial carcinógeno para humanos. Maraviroc no resultó mutagénico o genotóxico en una batería de ensayos in vitro e in vivo incluyendo mutación inversa en bacterias, aberraciones cromosomáticas en linfocitos humanos y micronúcleos en médula ósea de ratas. Toxicidad reproductiva: Fertilidad: Maraviroc no afectó el apareamiento o la fertilidad en ratas macho o hembra, y no afectó al esperma de ratas macho, tratadas con hasta 1000 mg/kg. La exposición en este nivel de dosificación corresponde a 39 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. Embarazo: Se realizaron estudios de desarrollo embriofetal en ratas y conejos a dosis de hasta 39 y 34 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. Los estudios con animales no revelaron evidencia de daño el feto por parte del maraviroc. Se llevaron a cabo estudios de desarrollo pre y post natal en dosis de hasta 27 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. El único efecto en las crías fue un ligero incremento en la actividad motora en las ratas macho con dosis altas tanto en animales destetados como en adultos, mientras que no se observaron efectos en hembras. Otros parámetros del desarrollo de estas crías, incluyendo fertilidad y desempeño reproductivo, no fueron afectados por la administración de maraviroc a la madre.
Indicaciones.
Tratamiento de combinación antirretroviral de adultos infectados solo con VIH-1 CCR-5 trópico, en pacientes no tratados, más pacientes tratados con Maraviroc que experimentan falla virológica y desarrollaron resistencia a la lamivudina comparada con efavirenz. Esta indicación está basada en la información de seguridad y eficacia de dos estudios clínicos doble ciego controlados con placebo en pacientes que ya habían recibido tratamiento previo y un estudio doble ciego, comparativo en pacientes sin tratamiento previo (referirse a Estudios Clínicos).
Dosificación.
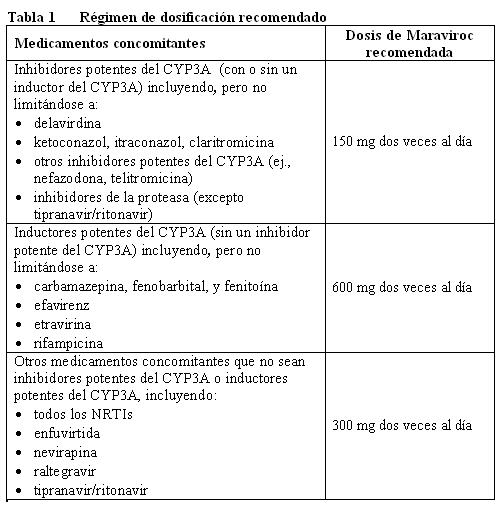
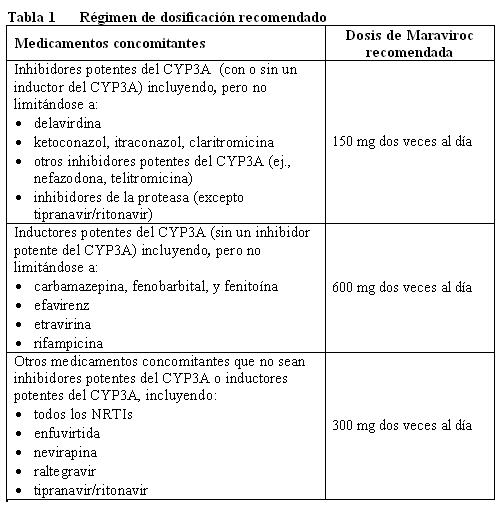
La terapia debe ser iniciada por un médico con experiencia en el manejo de infección por VIH. Al iniciar la terapia con maraviroc deberán considerarse los siguientes puntos: Para el uso apropiado de maraviroc se requiere de una prueba de tropismo (referirse a Advertencias y Precauciones). No se recomienda el uso de maraviroc en pacientes con VIH-1 con tropismo CXCR4 o dual/mixto, dado que no se demostró su eficacia en un estudio fase 2 en este grupo de pacientes. Maraviroc puede tomarse con o sin alimentos. Vía de administración: Adultos: La dosis recomendada de maraviroc es de 150 mg, 300 mg o 600 mg dos veces al día dependiendo de las interacciones con la terapia antirretroviral y con otros medicamentos co-administrados (referirse a la Tabla 1 e Interacciones).
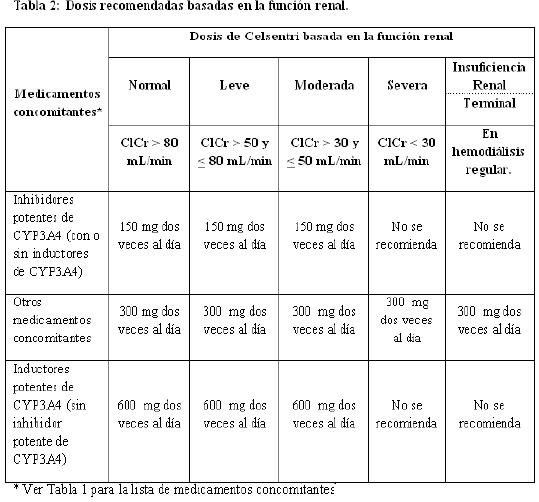
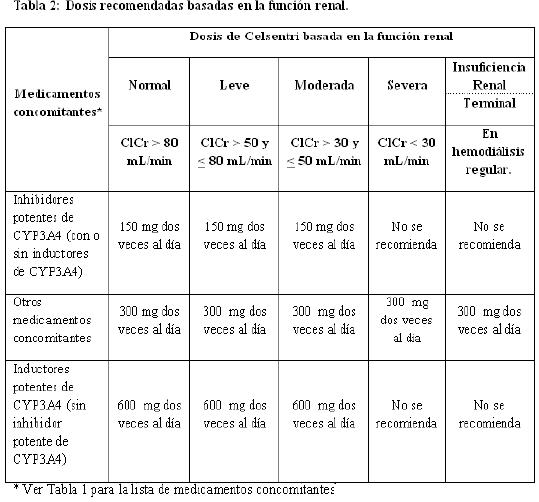
Niños: La seguridad y eficacia del uso de maraviroc en niños menores de 16 años de edad no ha sido establecida. Por lo tanto, no se recomienda su uso en niños. Pacientes de edad avanzada: La experiencia en pacientes mayores de 65 años de edad es limitada; por lo tanto, deberá ejercerse precaución cuando se administre maraviroc a pacientes de edad avanzada (ver Farmacocinética). Insuficiencia renal: La tabla 2 proporciona recomendaciones posológicas para pacientes, basado en la función renal y medicamentos concomitantes:
La dosis de Celsentri deberá reducirse a 150mg dos veces al día si aparecen síntomas de hipotensión postural. Insuficiencia hepática: La información limitada en pacientes con insuficiencia hepática leve a moderada demostró un pequeño incremento en la Cmáx del maraviroc, sugiriendo que no se requiere de un ajuste de la dosis. Sin embargo, maraviroc debe ser usado con precaución en pacientes con insuficiencia hepática (referirse a Advertencias y Precauciones y Farmacocinética).
Contraindicaciones.
Hipersensibilidad al ingrediente activo o cualquiera de los excipientes (ver Excipientes). Tampoco debe utilizarse en pacientes con disfunción renal severa o enfermedad renal terminal (Clcr < 30 mL/min) que están tomando inhibidores o inductores potentes de CYP3A4.
Reacciones adversas.
Información de estudios clínicos: Maraviroc ha sido estudiado en 1.374 pacientes infectados con VIH-1 que recibieron al menos una dosis de maraviroc durante tres estudios clínicos Fase 3. Esto incluye 426 pacientes que ya habian recibido tratamiento y 360 pacientes que no habían recibido tratamiento anteriormente, quienes recibieron 300 mg dos veces al día y 414 pacientes que ya habían recibido tratamiento y 174 pacientes que no habían recibido tratamiento previamente quienes recibieron 300 mg una vez al día. El perfil de seguridad de maravirox se basa en 786 pacientes infectados con VIH-1 quienes recibieron 300 mg de maraviroc dos veces al día. La evaluación de las reacciones adversas relacionadas con el tratamiento se basa en información combinada de dos estudios fase 3 en pacientes adultos que habían recibido tratamiento previamente (MOTIVATE 1 y MOTIVATE 2) y un estudio en pacientes adultos que no habían recibido tratamiento previamente (MERIT) en pacientes infectados con VIH-1, con tropismo CCR5. La tasa de descontinuación permanente debida a cualquier reacción adversa fue similar en pacientes que habían recibido el tratamiento previamente, recibiendo maraviroc dos veces al día + OBT (3,5%) y aquellos que recibieron OBT exclusivamente (3,3%) e inferior en pacientes que no habían recibido el tratamiento de previamente, recibiendo 300 mg de maraviroc dos veces al día en comparación con aquellos que recibieron efavirenz. Las reacciones adversas se encuentran enlistadas por clase de sistema orgánico (SOC - por sus siglas en inglés) y frecuencia. Dentro de cada grupo de frecuencia, los efectos indeseables se presentan en orden de gravedad decreciente. Las frecuencias se definen como muy común (≥ 1/10), común (≥ 1/100 a < 1/10), poco común (≥1/1.000 a < 1/100), raro (≥1/10.000 a < 1/1.000) y muy raro ( < 1/10.000). Las reacciones adversas y las anormalidades de laboratorio presentadas a continuación no están ajustados de acuerdo a la exposición. Pacientes que ya habían recibido tratamiento: Las tablas 4 y 5 resumen toda la información del tratamiento doble-ciego (dos veces al día=551, placebo=160 pacientes años de exposición) combinada a partir de los estudios Fase 3 MOTIVATE 1 y 2.
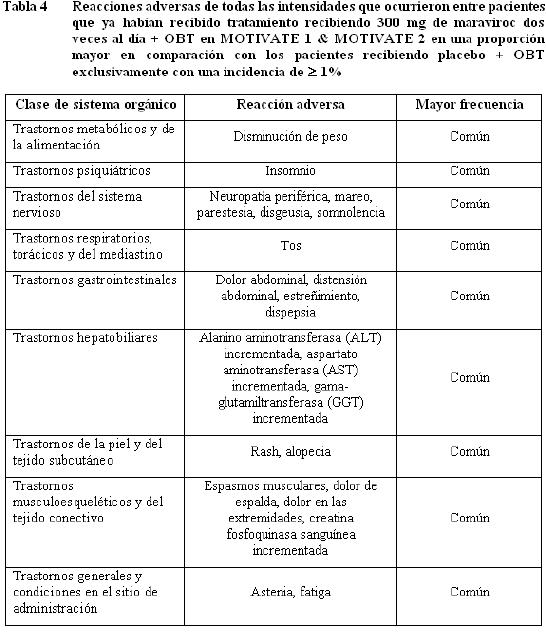
Anormalidades de laboratorio en pacientes que ya habían recibido tratamiento.
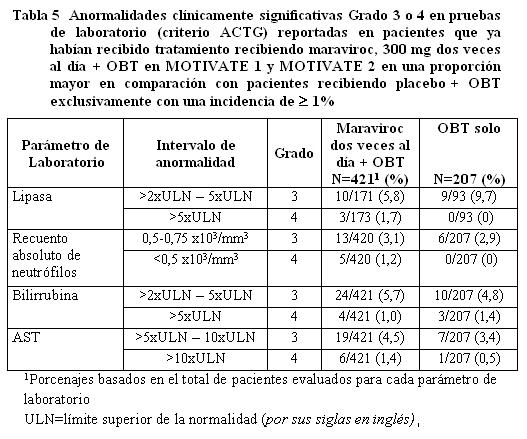
Pacientes que no habían recibido tratamiento previamente.
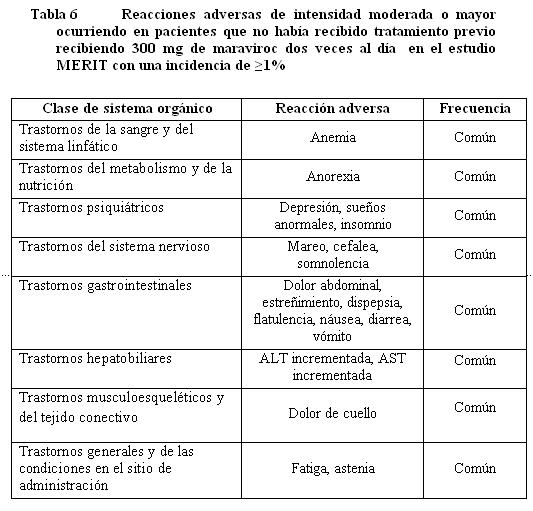
Anormalidades de laboratorio en pacientes que no habían recibido tratamiento previamente.
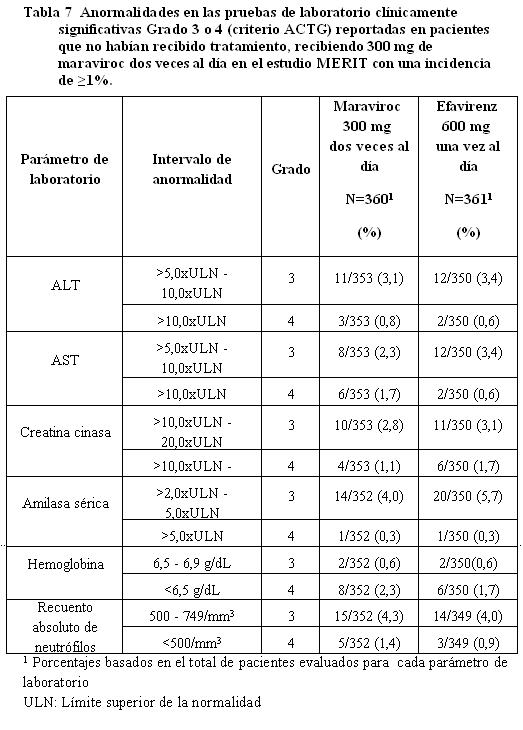
Otras reacciones adversas clínicamente significativas, de intensidad moderada o superior ocurrieron en menos de 1% de los pacientes adultos recibiendo maraviroc en estudios Fase 2b/3 incluyendo Síndrome de Stevens-Johnson. En pacientes infectados con VIH con deficiencia inmunitaria grave, puede surgir una reacción inflamatoria a infecciones oportunistas asintomáticas o residuales al momento de iniciar la terapia antirretroviral combinada (CART) (referirse a Advertencias y Precauciones). Información post comercialización: Muy ocasionalmente, se han reportado, reacciones de hipersensibilidad severas incluyendo rash medicamentoso con eosinofilia y síntomas sistémicos (DRESS) y reacciones cutáneas severas (SJS y TEN) así como hepatotoxicidad e insuficiencia hepática con características alérgicas en asociación con maraviroc en estudios clínicos y post comercialización.
Advertencias.
Seguridad hepática: Se ha observado un incremento en las reacciones adversas hepáticas con maraviroc durante los estudios con sujetos con infección por VIH que ya habían recibido tratamiento, a pesar de que no existió un incremento global en las anormalidades de las pruebas de función hepática Grados 3/4 del ACTG (referirse a Reacciones Adversas). Existieron menos casos de trastornos hepatobiliares reportados en pacientes que no habían recibido tratamiento previo y que se encontraban en tratamiento con maraviroc que en los que recibían efavirenz pero la incidencia global de eventos adversos hepáticos y las anormalidades en las pruebas de función hepática Grados 3/4 en pacientes que no habían recibido tratamiento previo fue similar entre maraviroc y efavirenz. Se han reportado casos de hepatotoxicidad e insuficiencia hepática con características alérgicas en asociación con maraviroc. Deberá considerarse poderosamente la discontinuación de maraviroc en cualquier paciente con signos o síntomas de hepatitis aguda, en particular si se sospecha de hipersensibilidad relacionada al fármaco o en pacientes con incremento en las transaminasas hepáticas combinado con rash u otros síntomas sistémicos de una potencial hipersensibilidad (ej. rash prurítico, eosinofilia o IgE elevada). Dado que existe información muy limitada en pacientes con co-infección de hepatitis B/C, deberá ejercerse especial precaución al tratar estos pacientes con maraviroc. En caso de terapia antiviral concomitante para la hepatitis B y/o C, favor de referirse también a la información del producto pertinente para estos medicamentos. Los pacientes con disfunción hepática pre-existente, incluyendo hepatitis crónica activa, pueden tener una mayor frecuencia de anormalidades en la función hepática durante la terapia antirretroviral combinada y deberán ser monitoreados conforme a la práctica estándar. La seguridad y eficacia de maraviroc no ha sido estudiada específicamente en pacientes con trastornos hepáticos subyacentes significativos. Dado que existe una experiencia limitada en pacientes con una función hepática reducida, maraviroc deberá usarse con precaución en esta población (referirse a Dosificación y Farmacocinética). Reacciones cutáneas y de hipersensibilidad graves: Se han reportado reacciones de hipersensibilidad incluyendo eventos graves y potencialmente riesgosos para la vida en pacientes tomando maraviroc, en la mayoría de los casos en forma concomitante con otros fármacos asociados con estas reacciones. Estas reacciones estuvieron caracterizadas por aspectos que incluyeron rash, hallazgos constitucionales, y algunas veces disfunción orgánica e insuficiencia hepática. Se han reportado casos de síndrome de Stevens-Johnson (SJS), necrólisis epidérmica tóxica (TEN) y rash medicamentoso con eosinofilia y síntomas sistémicos (DRESS) (referirse a Reacciones Adversas). Descontinúe maraviroc y otros agentes sospechosos inmediatamente si se desarrollan signos o síntomas de reacciones cutáneas o de hipersensibilidad graves. El retardo en la detención del tratamiento con maraviroc o con otros fármacos sospechosos después del establecimiento del rash puede tener como resultado una reacción que ponga en riesgo la vida. Deberá monitorearse el estado clínico incluyendo a las aminotransferasas hepáticas y la terapia apropiada iniciada. Seguridad cardiovascular: Utilícese con precaución en pacientes con un riesgo incrementado de eventos cardiovasculares. Durante los estudios Fase 3 en pacientes que habían recibido tratamiento previamente, con virus con tropismo CCR5, diez sujetos (1,2%) que recibieron maraviroc (en comparación con ninguno en el grupo placebo) presentaron eventos de cardiopatía isquémica [seis pacientes (1,4%) en el grupo de maraviroc una vez al día y cuatro pacientes (0,9%) en el grupo de dos veces al día]. Estos sujetos generalmente tenían cardiopatías o factores de riesgo cardíacos antes del uso de maraviroc, y la contribución relativa de maraviroc a estos eventos se desconoce. En el estudio Fase 2b/3 en pacientes que no habían recibido tratamiento previamente, tres sujetos (0,8%) que recibieron maraviroc presentaron eventos relacionados con cardiopatías isquémicas y cinco sujetos (1,4%) que recibieron efavirenz presentaron dichos eventos (exposición total 506 y 508 pacientes-años para maraviroc y efavirenz, respectivamente). Cuando se administró maraviroc en estudios con voluntarios sanos a dosis más elevadas que la dosis recomendada, se observaron casos de hipotensión postural sintomática con mayor frecuencia que con el placebo. Sin embargo, cuando se administró maraviroc a la dosis recomendada a pacientes infectados con VIH en estudios Fase 3, se observó hipotensión postural en una proporción similar en comparación con el placebo/comparador. Deberá tenerse precaución cuando se administre maraviroc a pacientes con un historial de hipotensión postural o que estén recibiendo medicamentos concomitantes que se sepa disminuyan la presión sanguínea. Insuficiencia Renal: Un estudio evaluó la farmacocinética y seguridad de maraviroc en sujetos con distintos grados de insuficiencia renal en comparación con voluntarios sanos. En este estudio se observaron disminuciones transitorias en la media de la depuración de creatinina en sujetos con insuficiencia renal leve a moderada así como en los voluntarios sanos que recibieron 150 mg de maraviroc (Frecuencia de dosificación: voluntarios sanos - una vez cada 12 horas; insuficiencia leve - una vez cada 24 horas; insuficiencia moderada - una vez cada 48 horas) y saquinavir/ritonavir 1000/100 mg dos veces al día la cual se resolvió con la dosificación continuada. No existió una relación entre la disminución en la media de la depuración de creatinina, y la creatinina sérica basal media. En general, maraviroc fue bien tolerado en este estudio reportándose más eventos adversos (la mayoría leves) en sujetos con insuficiencia renal leve a moderada recibiendo maraviroc y saquinavir/ritonavir. Puede ocurrir un incremento en el riesgo de hipotensión postural en pacientes con insuficiencia renal grave que sean tratados con inhibidores de la proteasa potenciados (PIs) y maraviroc. Este riesgo se debe al incremento potencial en las concentraciones máximas de maraviroc cuando maraviroc se co-administra con PIs potenciados en estos pacientes. El riesgo de hipotensión postural es mayor cuando maraviroc se co-administra con PIs que tengan el más potente efecto inhibitorio sobre la CYP3A (saquinavir/ ritonavir, darunavir/ ritonavir lopinavir/ ritonavir). Los pacientes con función renal deteriorada pueden presentar frecuentemente co-morbilidades cardiovasculares, y pueden encontrarse en un mayor riesgo de eventos adversos cardiovasculares que sean disparados por la hipotensión postural. No se han realizado estudios con sujetos con insuficiencia renal grave co-tratados con inhibidores potentes de la CYP3A. Los ajustes en los intervalos de dosificación se basan en modelos y simulaciones farmacocinéticas. Se proporcionan guías para el ajuste de la dosis y/o del intervalo para pacientes con insuficiencia renal con y sin inhibidores potentes de la CYP3A co-administrados en Dosificación, Interacciones y Farmacocinética. Síndrome de Reconstitución Inmune: En pacientes infectados con VIH con deficiencia inmune grave al momento del inicio de la terapia antirretroviral altamente activa (HAART), puede surgir una reacción infla
matoria a patógenos oportunistas asintomáticos o residuales y causar condiciones clínicas graves, o agravamiento de los síntomas. Normalmente, dichas reacciones se han observado dentro de las primeras semanas o meses de inicio de la HAART. Ejemplos relevantes son retinitis por citomegalovirus, infecciones micobacterianas generalizadas y/o localizadas, y neumonía causada por Pneumocystis jiroveci (conocido anteriormente como Pneumocystis carinii). Cualquier síntoma inflamatorio deberá ser evaluado y se deberá iniciar tratamiento cuando sea necesario. Tropismo: Maraviroc debe ser tomado como parte de un régimen antirretroviral combinado. En condiciones óptimas maraviroc deberá ser combinado con otros antirretrovirales a los que sea susceptible el virus del paciente (referirse a la Farmacodinamia). Maraviroc solamente deberá utilizarse cuando se detecta VIH-1 con tropismo CCR5 (es decir que no se detecten virus con tropismo CXCR4 o dual/mixto) determinado por un método de detección adecuadamente validado y sensible (referirse a Indicaciones, Dosificación y Farmacodinamia). El tropismo viral no puede predecirse a partir del historial de tratamiento o determinarse a partir de muestras almacenadas; sólo puede usarse una muestra fresca del paciente para determinar el tropismo viral. En pacientes infectados con VIH-1 pueden ocurrir cambios en el tropismo viral a través del tiempo. Por lo tanto, es necesario iniciar la terapia poco después de la prueba de tropismo. Ajuste de la dosis: Los médicos deben asegurarse de que se haga un ajuste adecuado de la dosis de maraviroc cuando maraviroc se co-administre con inhibidores y/o inductores de la CYP3A dado que pueden afectarse las concentraciones y/o los efectos terapéuticos del maraviroc (referirse Dosificación e Interacciones). Referirse a la información de producto respectiva de los demás medicamentos usados en combinación con maraviroc. Información para Pacientes: Debe advertirse a los pacientes que las terapias antirretrovirales incluyendo al maraviroc no han mostrado evitar el riesgo de transmisión de VIH a los demás mediante contacto sexual o contaminación con sangre. Ellos deben continuar usando las precauciones apropiadas. También deberá informarse a los pacientes que el maraviroc no es una cura para la infección por VIH-1.
Interacciones.
Maraviroc es un sustrato de la CYP3A4 del citocromo P450. La co-administración de maraviroc con medicamentos que induzcan a la CYP3A puede disminuir las concentraciones de maraviroc y reducir sus efectos terapéuticos. La co-administración de maraviroc con medicamentos que inhiban a la CYP3A puede incrementar las concentraciones plasmáticas de maraviroc. Se recomienda un ajuste de la dosis de maraviroc cuando maraviroc se co-administre con inhibidores y/o inductores de la CYP3A. A continuación se proporcionan mayores detalles de medicamentos administrados en forma concomitante (ver, Advertencias y Precauciones y). Estudios en microsomas hepáticos humanos y sistemas enzimáticos recombinantes han demostrado que el maraviroc no inhibe a ninguna de las enzimas P450 principales a concentraciones clínicamente relevantes (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 y CYP3A4). Maraviroc no tiene un efecto clínico relevante sobre la farmacocinética del midazolam, los anticonceptivos orales etinilestradiol y levonorgestrel, o la tasa urinaria 6b-hidroxicortisol/cortisol, sugiriendo que no hay inhibición o inducción de la CYP3A4 in vivo. A pesar de la ausencia de inhibición de la CYP2D6 in vitro, el maraviroc causó incremento en la tasa metabólica de debrisoquina a 600 mg una vez al día a pesar de que no ocurrió a 300 mg dos veces al día. Por lo tanto, no puede excluirse una inhibición potencial de la CYP2D6 a una mayor exposición a maraviroc. Con base en la información in vitro y clínica, el potencial de maraviroc de afectar la farmacocinética de los medicamentos co-administrados es baja. La depuración renal es responsable de aproximadamente 23% de la eliminación total de maraviroc cuando el maraviroc se administra sin inhibidores de la CYP3A. Dado que se involucran procesos tanto activos como pasivos, existe el potencial de una competencia por la eliminación con otros principios activos eliminados por vía renal. Sin embargo, la co-administración de maraviroc con tenofovir (sustrato para eliminación renal) y con Cotrimoxazol (contiene trimetoprima, un inhibidor del transporte catiónico renal), no mostró efecto sobre la farmacocinética del maraviroc. Además, la co-administración de maraviroc con lamivudina/zidovudina no mostró efectos del maraviroc sobre la farmacocinética de la lamivudina (eliminada principalmente por vía renal) o de la zidovudina (metabolismo no-P450 y eliminación renal). Maraviroc inhibe a la glicoproteína P in vitro (el IC50 es 183 mM). Sin embargo, maraviroc no afecta significativamente la farmacocinética de la digoxina in vivo, sugiriendo que maraviroc no inhibe ni induce la actividad de la glicoproteína-P.

Embarazo y lactancia: Fertilidad: No existe información sobre los efectos del maraviroc sobre la fertilidad humana. En ratas, no existieron efectos adversos sobre la fertilidad de machos o hembras (referirse a la Información Preclínica). Embarazo: No se cuenta con información clínica significativa sobre la exposición durante el embarazo. Los estudios con animales no indican efectos dañinos directos o indirectos con respecto al embarazo, desarrollo embrional /fetal, parto o desarrollo postnatal (referirse a Información Preclínica). Solo deberá usarse maraviroc durante el embarazo si el beneficio potencial justifica el riesgo potencial para el feto. Lactancia: Los estudios con ratas lactando indican que el maraviroc es extensamente excretado en la leche de ratas. Se desconoce si el maraviroc se excreta en la leche humana. Se deberá dar instrucciones a las madres de que no amamanten si están recibiendo maraviroc debido al potencial de transmisión del VIH y cualquier posible efecto indeseable en los lactantes. Capacidad para realizar tareas que requieran habilidades de juicio, motoras o cognitivas: No existen estudios que investiguen el efecto del maraviroc sobre la capacidad para realizar tareas que requieran habilidades de juicio, motoras o cognitivas. Sin embargo, deberá informarse a los pacientes acerca de la posible aparición de síntomas relacionados con la hipotensión postural como mareos cuando tomen maraviroc. Si resultan afectados, los pacientes deberán evitar tareas potencialmente peligrosas como conducir u operar maquinaria.
Incompatibilidades.
No se aplica.
Conservación.
Almacenar a no más de 30°C. Vida útil: La fecha de caducidad viene indicada en el empaque. Precauciones especiales de eliminación y manipulación del producto: Sin requerimientos especiales.
Sobredosificación.
Síntomas y signos: La mayor dosis administrada en estudios clínicos fue de 1.200 mg. La reacción adversa limitante de la dosis fue la hipotensión postural. Se observó prolongación del intervalo QT en perros y monos a concentraciones plasmáticas 6 a 12 veces superiores, respectivamente, con respecto a aquellas esperadas en humanos a la dosis máxima recomendada de 300 mg dos veces al día. Sin embargo, no se observó una prolongación clínicamente significativa de QT en comparación al OBT solo en estudios clínicos Fase 3 usando la dosis recomendada de maraviroc ni en un estudio farmacocinético específico para evaluar el potencial de maraviroc para prolongar el intervalo QT. Tratamiento: No existe un antídoto específico para la sobredosis con maraviroc. El tratamiento de la sobredosis debería consistir en medidas generales de soporte incluyendo mantener al paciente en posición supina, valoración cuidadosa de los signos vitales, presión sanguínea y ECG del paciente. Si está indicado, la eliminación del maraviroc activo no absorbido deberá hacerse por emesis. También puede usarse la administración de carbón activado para ayudar a la remoción de la sustancia activa no absorbida. Dado que el maraviroc se une moderadamente a las proteínas, la diálisis puede resultar beneficiosa para retirar este medicamento. El manejo ulterior deberá ser como lo recomiende el centro nacional de envenenamiento, donde se encuentre disponible.
Presentación.
Blíster de PVC/Aluminio, en estuche de cartulina que contiene 60 comprimidos recubiertos.
CELSENTRI
GLAXOSMITHKLINE
Comprimidos Recubiertos de 300 mg
Antirretroviral.
Composición.
Comprimidos de 300 mg: Cada comprimido recubierto contiene 300 mg de maraviroc. Los comprimidos recubiertos de 300 mg son ovalados, biconvexos, de color azul, grabados con "MVC" en una cara y "300" en la otra. Presentación farmacéutica: Comprimidos recubiertos. Lista de Excipientes: Núcleo de la tableta: Celulosa microcristalina. Fosfato ácido de calcio (anhidro). Almidón glicolato de sodio. Estearato de magnesio. Recubrimiento: Alcohol polivinílico. Dióxido de titanio. Polietilén glicol (macrogol 3350). Talco. Lecitina de soya. FD&C azul No.2 laca de aluminio.
Farmacología.
Farmacodinamia: Código ATC. Grupo farmacoterapéutico: Antivirales para uso sistémico, Otros antivirales código ATC: J05AX09. Mecanismo de acción: El maraviroc es un miembro de una clase terapéutica llamada antagonistas del CCR5. El maraviroc se une selectivamente al receptor humano de quimiocina CCR5, evitando que el VIH-1 con tropismo CCR5 ingrese a las células. Efectos farmacodinámicos: Actividad antiviral en cultivos celulares: El valor CE90 en 43 aislados clínicos primarios de VIH-1 con tropismo CCR5 fue de 0,57 (0,06 - 10,7) nanogramos/mL (fracción no unida), sin cambios significativos entre los diferentes subtipos evaluados. Maraviroc no tiene actividad antiviral en cultivos celulares contra virus que puedan usar al CXCR4 como su co-receptor de ingreso (virus con tropismo dual o con tropismo CXCR4, colectivamente llamados virus 'usuarios del CXCR4' a continuación). La actividad antiviral del maraviroc contra el VIH-2 no ha sido evaluada. Cuando se usó con otros medicamentos antirretrovirales en cultivos celulares, la combinación con maraviroc no causó antagonismo con una gama de NRTIs, NNRTIs, PIs o con el inhibidor de la fusión del VIH enfuvirtida. Resistencia: El escape viral del maraviroc puede ocurrir por medio de dos rutas: la selección de virus que puedan usar al CXCR4 como su co-receptor de ingreso (virus usuarios del CXCR4) o la selección de virus que continúen usando exclusivamente al CCR5 (virus con tropismo CCR5). Resistencia en cultivos celulares: Se han seleccionado en cultivos celulares variantes del VIH-1 con susceptibilidad reducida a maraviroc, después de pasajes seriados de dos aislados virales clínicos con tropismo CCR5. Los virus resistentes al maraviroc continuaron teniendo tropismo CCR5 y no hubo una conversación de un virus con tropismo CCR5 a virus usuarios de CXCR4. Resistencia fenotípica: las curvas de concentración respuesta para los virus resistentes al maraviroc se caracterizaron por ser curvas que no alcanzaron el 100% de inhibición en ensayos usando diluciones seriales de maraviroc. El tradicional cambio en el número de veces de la CE50 no resultó un parámetro útil para medir la resistencia fenotípica, dado que dichos valores algunas veces permanecieron sin cambio a pesar de que la sensibilidad estaba significativamente reducida. Resistencia genotípica: se encontró que las mutaciones se acumulaban en la glicoproteína gp120 de la envoltura (la proteína viral que se une al co-receptor CCR5). La posición de estas mutaciones no fue consistente entre los diferentes aislados. Por lo tanto, se desconoce la importancia de estas mutaciones para la susceptibilidad al maraviroc en otros virus. Resistencia cruzada: todos los aislados clínicos de VIH-1 resistentes a los inhibidores de la transcriptasa inversa análogos de nucleósidos (NRTI), a los inhibidores de la transcriptasa inversa no análogos de nucleósidos (NNRTI), a los inhibidores de la proteasa (PI) y a la enfuvirtida fueron susceptibles al maraviroc en cultivos celulares. Los virus resistentes al maraviroc que surgieron en el cultivo celular permanecieron sensibles al inhibidor de la fusión enfuvirtida y al inhibidor de la proteasa saquinavir. In vivo: En los estudios clínicos se han observado ambas rutas hacia la resistencia tanto en pacientes que no habían recibido tratamiento como en pacientes que habían recibido tratamiento previamente. La presencia de virus usuarios de CXCR4 en la falla virológica parece originarse a partir de una población viral preexistente. Las pruebas previas a la terapia en busca de la presencia de esta forma viral pueden reducir la incidencia de falla mediante este mecanismo. En pacientes en los que fracasa la terapia, con virus R5 exclusivamente, puede considerarse que el maraviroc aún está activo si el valor de la máxima inhibición porcentual (MPI) es ≥95% (Ensayo Phenosense Entry). La actividad residual in vivo para virus con valor de MPI < 95% no se ha determinado. La resistencia de los virus R5 mediante el incremento de la CE50 no parece ser un mecanismo de fracaso importante. Resistencia genotípica: en este momento no pueden sugerirse las mutaciones clave (región V3) debido a la alta variabilidad de la secuencia V3 y al bajo número de muestras analizadas. Pacientes que ya han recibido tratamiento: En los estudios fundamentales (MOTIVATE 1 y MOTIVATE 2), 7,6% de los pacientes presentaron un cambio en el resultado de tropismo de tropismo CCR5 a tropismo CXCR4 o dual/mixto entre la exploración y el inicio (un periodo de cuatro-seis semanas). Fracaso con virus usuarios de CXCR4: En aproximadamente 55% de los sujetos en los que fracasó el tratamiento con maraviroc, se detectaron virus usuarios de CXCR4 al momento del fracaso, en comparación con 6% de sujetos que experimentaron fracaso del tratamiento en el brazo de OBT solo. Para investigar el probable origen de los virus usuarios de CXCR4 durante el tratamiento, se llevó a cabo un análisis clonal detallado en virus de 20 sujetos representativos (16 sujetos de los brazos de maraviroc y cuatro sujetos del brazo de OBT solo) en las que se había detectado virus usuarios de CXCR4. Este análisis indicó que los virus usuarios de CXCR4 surgieron de un reservorio preexistente de virus usuarios de CXCR4 que no fue detectado en el punto de partida, más que de una mutación de los virus con tropismo CCR5 presentes en el punto de partida. Un análisis de tropismo que siguió al fracaso de la terapia con maraviroc con virus usuarios de CXCR4 en pacientes con virus CCR5 al inicio, demostró que la población viral revirtió a tropismo CCR5 en 33 de 36 pacientes con más de 35 días de seguimiento. Al momento del fracaso con virus usuarios de CXCR4, el patrón de resistencia a otros antirretrovirales parece ser similar al de la población con tropismo CCR5 al inicio, con base en la información disponible. Por lo tanto en la selección del régimen de tratamiento, debe asumirse que los virus que forman parte de la población de virus usuarios de CXCR4 no detectados previamente (es decir la población viral minoritaria) albergan los mismos patrones de resistencia que la población con tropismo CCR5. Fracaso con virus con tropismo CCR5: Resistencia fenotípica: en pacientes con virus con tropismo CCR5 al momento del fracaso al tratamiento con maraviroc, 22 de 58 pacientes tenían virus con una sensibilidad reducida al maraviroc. Adicionalmente, los virus con tropismo CCR5 de 2 sujetos en los que fracasó el tratamiento tenían incrementos 3 veces en los valores de CE50 para maraviroc al momento del fracaso, pero la importancia de esto no es clara. En los pacientes restantes, no hubo evidencia de virus con una sensibilidad reducida lo cual se identificó mediante análisis biológicos exploratorios en un grupo representativo. Este último grupo tenía marcadores de baja exposición, en algunos casos asociados con una baja adherencia al tratamiento. Pacientes que no habían recibido tratamiento previo: En el estudio fundamental (MERIT), 3,8% (13/343) de pacientes presentaron un cambio en el resultado del tropismo de tropismo CCR5 a tropismo CXCR4 o dual/mixto entre la exploración y el inicio, (período de cuatro cuatro-seis semanas). Fracaso con virus usuarios de CXCR4: Se detectaron virus usuarios de CXCR4 en aproximadamente 28% (24/86) de sujetos con virus con tropismo CCR5 al inicio y en los que fracasó el tratamiento con maraviroc, en comparación con ninguno de los sujetos que experimentaron fracaso del tratamiento en el brazo de efavirenz. Con base en un re-análisis, cuando los sujetos que presentaban virus usuarios CXCR4 en la exploración, detectados usando un ensayo de tropismo con sensibilidad mejorada, fueron censurados del análisis, de los sujetos con virus con tropismo CCR5 inicialmente y en los que fracasó el tratamiento con maraviroc, se detectaron virus usuarios de CXCR4 en 21% (25/118) en comparación con ninguno en el brazo de efavirenz. Se realizó un análisis clonal detallado en dos sujetos que no habían recibido tratamiento previo con antirretrovirales enrolados en un estudio con monoterapia Fase 2a y en los que se había observado virus usuarios CXCR4 después de 10 días de tratamiento con maraviroc. En forma consistente con el análisis clonal detallado realizado en sujetos que ya habían recibido tratamiento, se encontró que la variante de virus usuarios de CXCR4 existía antes del inicio de la terapia. Fracaso con virus con tropismo CCR5: Resistencia fenotípica: en pacientes con virus con tropismo CCR5 al momento del fracaso del tratamiento con maraviroc, 6 de 38 pacientes tenían virus con una sensibilidad reducida al maraviroc. En los 32 pacientes restantes, no había evidencia de virus con sensibilidad reducida lo cual se identificó mediante ensayos virológicos exploratorios en un grupo representativo. Un sujeto adicional presentaba un incremento de ≥3 veces en el valor CE50 para maraviroc al momento del fracaso. Farmacocinética: Absorción: La absorción del maraviroc es variable y con picos múltiples. La mediana de las concentraciones plasmáticas máximas de maraviroc se obtiene a las dos horas (intervalo 0,5-4 horas) después de una dosis oral única de una tableta comercial de 300 mg administrada a voluntarios sanos. La farmacocinética del maraviroc oral no es proporcional a la dosis en el intervalo de 1-1200 mg. La biodisponibilidad absoluta de una dosis de 100 mg es de 23% y se predice que sea de 33% a 300 mg. El maraviroc es un sustrato de la glicoproteína P, un transportador de eflujo. La co-administración de una tableta de 300 mg con un desayuno alto en grasas redujo la Cmáx y el ABC del maraviroc en un 33% en voluntarios sanos. No existieron restricciones en la alimentación en los estudios que demostraron la eficacia y seguridad del maraviroc (referirse a Farmacodinamia). Por lo tanto, el maraviroc puede tomarse con o sin alimentos a las dosis recomendadas (referirse a Dosificación). Distribución: El maraviroc se une a las proteínas plasmáticas humanas (aproximadamente 76%) y muestra una afinidad moderada por la albúmina y la alfa-1 glucoproteína ácida. El volumen de distribución del maraviroc es de aproximadamente 194L. Metabolismo: Estudios con humanos y estudios in vitro usando microsomas hepáticos humanos y enzimas expresadas, han demostrado que el maraviroc se metabolizada principalmente por medio del sistema del citocromo P450 a metabolito que son esencialmente inactivos contra el VIH-1. Los estudios in vitro indican que la CYP3A es la principal enzima responsable del metabolismo del maraviroc. Los estudios in vitro también indican que las enzimas polimórficas CYP2C9, CYP2D6 y CYP2C19 no contribuyen significativamente al metabolismo del maraviroc. El maraviroc es el principal componente circulante (aproximadamente 42% de la radiactividad) después de una dosis oral única de 300 mg. El metabolitos circulante más significativo en el humano es una amina secundaria (aproximadamente 22% de la radiactividad) formada por N-desalquilación. Este metabolito polar no tiene actividad farmacológica significativa. Otros metabolitos son productos de la monooxidación y solamente son componentes menores de la radioctividad plasmática. Eliminación: Se realizó un estudio de excreción/balance de masa usando una dosis única de 300 mg de maraviroc marcado con 14C. Aproximadamente 20% de sustancia radiomarcada fue recuperado en la orina y 76% fue recuperado en las heces después de 168 horas. El maraviroc fue el principal componente presente en la orina (en promedio 8% de la dosis) y en las heces (en promedio 25% de la dosis). La cantidad restante fue excretada como metabolitos. Después de la administración intravenosa (30 mg), la vida media del maraviroc fue de 13,2 horas, 22% de la dosis se excretó sin cambio en la orina y los valores de depuración total y depuración renal fueron de 44,0 L/hora y 10,2 L/hora respectivamente. Poblaciones de pacientes especiales: Niños: No se ha establecido la farmacocinética del maraviroc en niños menores de 16 años de edad (referirse a Dosificación). Adultos mayores: Se realizó el análisis poblacional de los estudios Fase 1/2a y Fase 3 (16-65 años de edad) y no se observó un efecto de la edad. No se ha establecido la farmacocinética del maraviroc en pacientes mayores de 65 años de edad (referirse a Dosificación). Insuficiencia renal: Un estudio comparó la farmacocinética de una dosis única de 300 mg de maraviroc en sujetos con insuficiencia renal grave (depuración de creatinina < 30 mL/min, n=6) y enfermedad renal en estado terminal (ESRD) contra voluntarios sanos (n=6). La media geométrica del ABCinf (CV%) para maraviroc fue como sigue: voluntarios sanos (función renal normal) 1348,4 nanogramos·h/mL (61%); insuficiencia renal grave 4367,7 nanogramos·h/mL (52%); ESRD (dosificación después de la diálisis) 2677,4 nanogramos·h/mL (40%); y ESRD (dosificación antes de la diálisis) 2805,5 nanogramos·h/mL (45%). La Cmáx (CV%) fue de 335,6 nanogramos/mL (87%) en los voluntarios sanos (función renal normal); 801,2 nanogramos/mL (56%) insuficiencia renal grave; 576,7 nanogramos/mL (51%) en ESRD (dosificación después de la diálisis) y 478,5 nanogramos/mL (38%) en ESRD (dosificación antes de la diálisis). La diálisis tuvo un efecto mínimo sobre la exposición en sujetos con ESRD. Las exposiciones observadas en sujetos con insuficiencia renal grave y con ESRD se encontraron dentro del intervalo de las observadas en estudios con dosis única de 300 mg de maraviroc en voluntarios sanos con función renal normal. Por lo tanto, no es necesario un ajuste de dosis en pacientes con insuficiencia renal recibiendo maraviroc sin un inhibidor potente de la CYP3A (referirse a Dosificación, Advertencias y Precauciones e Interacciones). Además, el estudio comparó la farmacocinética de dosis múltiples de maraviroc en combinación con saquinavir/ritonavir 1000/100 mg dos veces al día (una combinación de inhibidores potentes de la CYP3A) durante siete días en sujetos con insuficiencia renal leve (depuración de creatinina > 50 y 80 mL/min, n=6) e insuficiencia en renal moderada (depuración de creatinina 30 y 50 mL/min, n=6) contra voluntarios sanos (n=6). Los sujetos recibieron 150 mg de maraviroc en diferentes frecuencias de dosificación (voluntarios sanos - cada 12 horas; insuficiencia renal leve - cada 24 horas; insuficiencia renal moderada - cada 48 horas). La concentración promedio (Cavg) del maraviroc a lo largo de 24 horas fue de 445,1 nanogramos/mL, 338,3 nanogramos/mL, and 223,7 nanogramos/mL para sujetos con función renal normal, insuficiencia renal leve, e insuficiencia renal moderada, respectivamente. La Cavg del maraviroc de 24-48 horas para sujetos con insuficiencia renal moderada fue baja (Cavg: 32,8 nanogramos/mL). Por lo tanto, en sujetos con insuficiencia renal moderada (y por extrapolación en insuficiencia renal grave) la frecuencia de dosificación de más de 24 horas puede resultar en una exposición inadecuada entre las 24 y 48 horas. En pacientes con insuficiencia renal recibiendo maraviroc con inhibidores potentes de la CYP3A se recomienda una dosis de 150 mg cada 24 horas (referirse a Dosificación, Advertencias y Precauciones e Interacciones). Insuficiencia hepática: El maraviroc se metabolizada y elimina principalmente por el hígado. Un estudio comparó la farmacocinética de una dosis única de 300 mg de maraviroc en pacientes con insuficiencia hepática (Child-Pugh Clase A, n=8), y moderada (Child-Pugh Clase B, n=8) contra sujetos sanos (n=8). El cociente de las medias geométricas para Cmáx y ABC última fueron 11% y 25% superiores respectivamente para sujetos con insuficiencia hepática leve, y 32% y 46% superiores respectivamente para sujetos con insuficiencia hepática moderada en comparación con sujetos con función hepática normal. Los efectos de la insuficiencia hepática moderada pueden haber sido subestimados debido a la limitada información en pacientes con capacidad metabólica disminuida y mayor depuración renal en estos sujetos. Por lo tanto los resultados deben ser interpretados con precaución. No se ha estudiado la farmacocinética del maraviroc en sujetos con insuficiencia hepática grave (referirse a Dosificación y Advertencias y Precauciones). Otras características del paciente: Raza: El análisis de la farmacocinética poblacional de información combinada Fase 1/2a indicó que la exposición fue 26,5% superior en asiáticos (n=95) en comparación con no asiáticos (n=318). Sin embargo, un estudio diseñado para evaluar la diferencia farmacocinética entre caucásicos (n=12) y asiáticos (n=12) no mostró diferencia entre estas dos poblaciones. El análisis farmacocinético poblacional de la información de todos los sujetos que recibieron maraviroc en MERIT mostró una exposición superior con significancia estadística (17,5%) en personas de raza negra (n=143) y otras razas (n=35) combinados en comparación con blancos (n=327) y asiáticos (n=10) combinados. No es necesario un ajuste de dosis en base a la raza. Sexo: el análisis farmacocinético poblacional de información combinada Fase 1/2a indica que el sexo (mujeres: n=96, 23,2% de la población total) no afecta a las concentraciones de maraviroc. No es necesario un ajuste de dosis en base al sexo. Estudios clínicos: Estudios en pacientes que ya hayan recibido tratamiento, con tropismo CCR5: Se ha investigado la eficacia clínica del maraviroc (en combinación con otros medicamentos antirretrovirales) en los niveles plasmáticos de RNA de VIH y los recuentos de células CD4+ en dos estudios fundamentales, aleatorizados, doble ciego, multicéntricos (MOTIVATE-1 y MOTIVATE-2, n=1049) en pacientes infectados con VIH-1 con tropismo CCR5 (determinado mediante el ensayo de Trofile). El criterio de valoración principal de eficacia fue a las 48 semanas. Los pacientes elegibles para estos estudios habían tenido exposición previa a al menos tres clases de medicamentos antirretrovirales [≥1 inhibidor de la transcritasa inversa análogo de nucleósido (NRTI), ≥1 inhibidor de la transcritasa inversa no análogo de nucleósido (NNRTI), ≥2 inhibidor de la proteasa (PI), y/o enfuvirtida] o resistencia documentada a al menos un miembro de cada clase. Los pacientes fueron aleatorizados en una relación 2:2:1 a maraviroc 300 mg (dosis equivalente) una vez al día, dos veces al día o placebo en combinación con una Terapia de Base Optimizada (OBT) consistente en tres a seis medicamentos antirretrovirales (excluyendo ritonavir a bajas dosis). El OBT se seleccionó en base al historial de tratamientos previos del sujeto y en las determinaciones basales de resistencia viral genotípica y fenotípica.
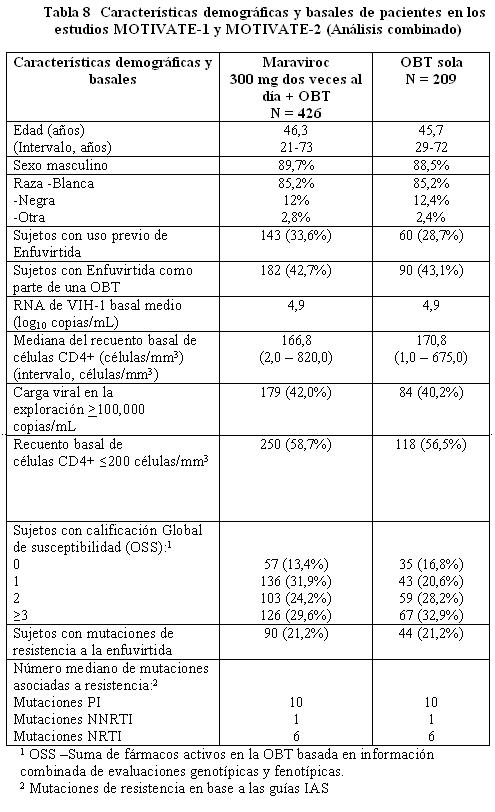
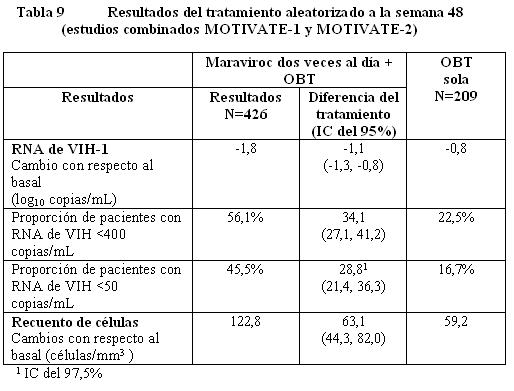
Maraviroc dos veces al día + OBT fue superior a OBT sola en todos los subgrupos de pacientes analizados (ver Tabla 10).
Estudios en pacientes que ya habían recibido tratamiento con tropismo No-CCR5: El estudio A4001029 fue un estudio exploratorio, multicéntrico, doble ciego, aleatorizado, para determinar la seguridad y eficacia del maraviroc en sujetos infectados con VIH-1 con tropismo/mixto o tropismo CXCR4, Los criterios de inclusión/exclusión fueron similares a los de MOTIVATE-1 y MOTIVATE-2 antes mencionados y los sujetos fueron aleatorizados en una proporción 1:1:1 a maraviroc una vez al día, maraviroc dos veces al día o placebo. No se observó incremento en el riesgo de infección o de progresión de la enfermedad por VIH en los sujetos que recibieron maraviroc. El uso de maraviroc no se asoció con una disminución significativa en el RNA de VIH-1 en comparación con placebo en estos sujetos y no se observó un efecto adverso en el recuento de CD4. Estudios en Pacientes con tropismo CCR5 que no habían recibido tratamiento previo: El estudio A4001026 (MERIT) es un estudio aleatorizado, doble ciego, multicéntrico, en sujetos infectados con VIH-1 con tropismo CCR5 clasificados mediante el ensayo de tropismo TrofileTM. Se requirió que los sujetos tuvieran RNA de VIH-1 ≥2000 copias/mL y no podían: 1) haber recibido previamente una terapia antirretroviral por > 14 días, y 2) presentar una infección oportunista activa o reciente o una sospecha de infección primaria por VIH-1, o 3) tener una resistencia fenotípica o genotípica a la zidovudina, lamivudina, o efavirenz. Los sujetos fueron aleatorizados en una proporción 1:1:1 a maraviroc 300 mg una vez al día, maraviroc 300 mg dos veces al día, o efavirenz 600 mg una vez al día, cada uno en combinación con zidovudina/lamivudina. La eficacia y seguridad del maraviroc se basa en la comparación del maraviroc dos veces al día contra efavirenz. Las características demográficas y basales de los grupos de maraviroc y efavirenz fueron comparables (ver Tabla 11). Los sujetos fueron clasificados por niveles de RNA de VIH-1 y por región geográfica. La mediana del recuento de células CD4 y el RNA de VIH-1 basal fue similar para ambos grupos de tratamiento.
En la Tabla 12 se muestran los resultados del tratamiento a la semana 48. Los criterios de valoración de eficacia principales se definieron como el porcentaje de sujetos con RNA de VIH-1 no detectable por los métodos estándar y ultrasensible ( < 400 copias/mL y < 50 copias/mL). Después de 48 semanas de terapia combinada con zidovudina/lamivudina, 300 mg de maraviroc dos veces al día demostró no inferioridad frente a 600 mg de efavirenz una vez al día en la proporción de pacientes con carga viral indetectable determinada a < 400 copias/mL pero no a < 50 copias/mL (límite inferior del IC > -10% para no inferioridad). La mediana del incremento a partir del valor basal en el recuento de células CD4+ a la semana 48 fue de 180 células /mm3 para el brazo de maraviroc en comparación con 151 células /mm3 para el brazo de efavirenz.
Se concluyó un re-análisis de las muestras analizadas de MERIT usando un ensayo para tropismo más sensible (Trofile-ES) el cual estuvo disponible después del análisis a la semana 48 y mostró que aproximadamente 15% de los pacientes identificados con tropismo CCR5 en el análisis primario tenían virus No-R5. La exclusión de estos pacientes tuvo como resultado que el límite inferior del intervalo de confianza del 97,5% de un solo lado para la diferencia entre tratamientos para maraviroc y efavirenz quedara por arriba de -10% para < 400 y < 50 copias/mL (ver Tabla 13).
Información preclínica: La información Preclínica no revela un peligro especial para humanos en base a estudios convencionales de farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico, o toxicidad reproductiva. Carcinogénesis/mutagénesis: Se evaluó el potencial carcinógeno del maraviroc mediante un estudio de seis meses con ratones transgénicos y un estudio de 24 meses en ratas. En ratones, el maraviroc no causó un incremento clínicamente significativo en la incidencia de cualquier tipo de tumor a exposiciones sistémicas en el intervalo de 7 a 39 veces la exposición humana (en base a la determinación del ABC0-24hr de la fracción no unida) a la dosis máxima recomendada de 300 mg dos veces al día. En ratas, la administración de maraviroc produjo adenomas tiroideos asociados con cambios adaptativos en el hígado, a una exposición sistémica de 21 veces la exposición humana con 300 mg dos veces al día. No hubo indicaciones de un potencial carcinógeno para humanos. Maraviroc no resultó mutagénico o genotóxico en una batería de ensayos in vitro e in vivo incluyendo mutación inversa en bacterias, aberraciones cromosomáticas en linfocitos humanos y micronúcleos en médula ósea de ratas. Toxicidad reproductiva: Fertilidad: Maraviroc no afectó el apareamiento o la fertilidad en ratas macho o hembra, y no afectó al esperma de ratas macho, tratadas con hasta 1000 mg/kg. La exposición en este nivel de dosificación corresponde a 39 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. Embarazo: Se realizaron estudios de desarrollo embriofetal en ratas y conejos a dosis de hasta 39 y 34 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. Los estudios con animales no revelaron evidencia de daño el feto por parte del maraviroc. Se llevaron a cabo estudios de desarrollo pre y post natal en dosis de hasta 27 veces el ABC clínico estimado de la fracción libre para una dosis de 300 mg dos veces al día. El único efecto en las crías fue un ligero incremento en la actividad motora en las ratas macho con dosis altas tanto en animales destetados como en adultos, mientras que no se observaron efectos en hembras. Otros parámetros del desarrollo de estas crías, incluyendo fertilidad y desempeño reproductivo, no fueron afectados por la administración de maraviroc a la madre.
Indicaciones.
Tratamiento de combinación antirretroviral de adultos infectados solo con VIH-1 CCR-5 trópico, en pacientes no tratados, más pacientes tratados con Maraviroc que experimentan falla virológica y desarrollaron resistencia a la lamivudina comparada con efavirenz. Esta indicación está basada en la información de seguridad y eficacia de dos estudios clínicos doble ciego controlados con placebo en pacientes que ya habían recibido tratamiento previo y un estudio doble ciego, comparativo en pacientes sin tratamiento previo (referirse a Estudios Clínicos).
Dosificación.
La terapia debe ser iniciada por un médico con experiencia en el manejo de infección por VIH. Al iniciar la terapia con maraviroc deberán considerarse los siguientes puntos: Para el uso apropiado de maraviroc se requiere de una prueba de tropismo (referirse a Advertencias y Precauciones). No se recomienda el uso de maraviroc en pacientes con VIH-1 con tropismo CXCR4 o dual/mixto, dado que no se demostró su eficacia en un estudio fase 2 en este grupo de pacientes. Maraviroc puede tomarse con o sin alimentos. Vía de administración: Adultos: La dosis recomendada de maraviroc es de 150 mg, 300 mg o 600 mg dos veces al día dependiendo de las interacciones con la terapia antirretroviral y con otros medicamentos co-administrados (referirse a Interacciones).
Niños: La seguridad y eficacia del uso de maraviroc en niños menores de 16 años de edad no ha sido establecida. Por lo tanto, no se recomienda su uso en niños. Pacientes de edad avanzada: La experiencia en pacientes mayores de 65 años de edad es limitada; por lo tanto, deberá ejercerse precaución cuando se administre maraviroc a pacientes de edad avanzada (ver Farmacocinética). Insuficiencia renal: La tabla 2 proporciona recomendaciones posológicas para pacientes, basado en la función renal y medicamentos concomitantes:
La dosis de Celsentri deberá reducirse a 150mg dos veces al día si aparecen síntomas de hipotensión postural. Insuficiencia hepática: La información limitada en pacientes con insuficiencia hepática leve a moderada demostró un pequeño incremento en la Cmáx del maraviroc, sugiriendo que no se requiere de un ajuste de la dosis. Sin embargo, maraviroc debe ser usado con precaución en pacientes con insuficiencia hepática (referirse a Advertencias y Precauciones y Farmacocinética).
Contraindicaciones.
Hipersensibilidad al ingrediente activo o cualquiera de los excipientes (ver Excipientes). Tampoco debe utilizarse en pacientes con disfunción renal severa o enfermedad renal terminal (Clcr < 30 mL/min) que están tomando inhibidores o inductores potentes de CYP3A4.
Reacciones adversas.
Información de estudios clínicos: Maraviroc ha sido estudiado en 1.374 pacientes infectados con VIH-1 que recibieron al menos una dosis de maraviroc durante tres estudios clínicos Fase 3. Esto incluye 426 pacientes que ya habian recibido tratamiento y 360 pacientes que no habían recibido tratamiento anteriormente, quienes recibieron 300 mg dos veces al día y 414 pacientes que ya habían recibido tratamiento y 174 pacientes que no habían recibido tratamiento previamente quienes recibieron 300 mg una vez al día. El perfil de seguridad de maravirox se basa en 786 pacientes infectados con VIH-1 quienes recibieron 300 mg de maraviroc dos veces al día. La evaluación de las reacciones adversas relacionadas con el tratamiento se basa en información combinada de dos estudios fase 3 en pacientes adultos que habían recibido tratamiento previamente (MOTIVATE 1 y MOTIVATE 2) y un estudio en pacientes adultos que no habían recibido tratamiento previamente (MERIT) en pacientes infectados con VIH-1, con tropismo CCR5. La tasa de descontinuación permanente debida a cualquier reacción adversa fue similar en pacientes que habían recibido el tratamiento previamente, recibiendo maraviroc dos veces al día + OBT (3,5%) y aquellos que recibieron OBT exclusivamente (3,3%) e inferior en pacientes que no habían recibido el tratamiento de previamente, recibiendo 300 mg de maraviroc dos veces al día en comparación con aquellos que recibieron efavirenz. Las reacciones adversas se encuentran enlistadas por clase de sistema orgánico (SOC - por sus siglas en inglés) y frecuencia. Dentro de cada grupo de frecuencia, los efectos indeseables se presentan en orden de gravedad decreciente. Las frecuencias se definen como muy común (≥ 1/10), común (≥ 1/100 a < 1/10), poco común (≥1/1.000 a < 1/100), raro (≥1/10.000 a < 1/1.000) y muy raro ( < 1/10.000). Las reacciones adversas y las anormalidades de laboratorio presentadas a continuación no están ajustados de acuerdo a la exposición. Pacientes que ya habían recibido tratamiento: La y resumen toda la información del tratamiento doble ciego (dos veces al día=551, placebo=160 pacientes años de exposición) combinada a partir de los estudios Fase 3 MOTIVATE 1 y 2.
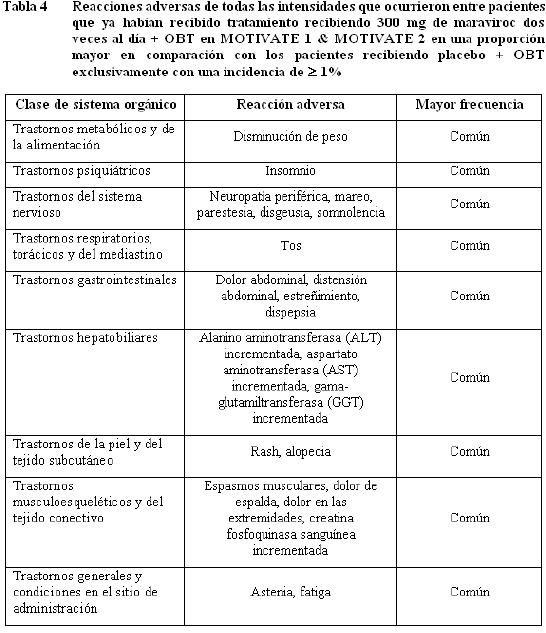
Anormalidades de laboratorio en pacientes que ya habían recibido tratamiento.
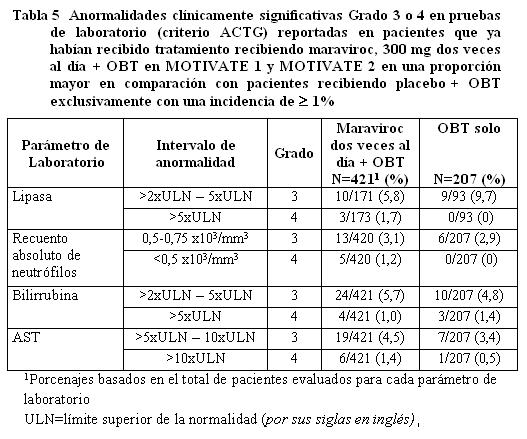
Pacientes que no habían recibido tratamie
nto previamente.
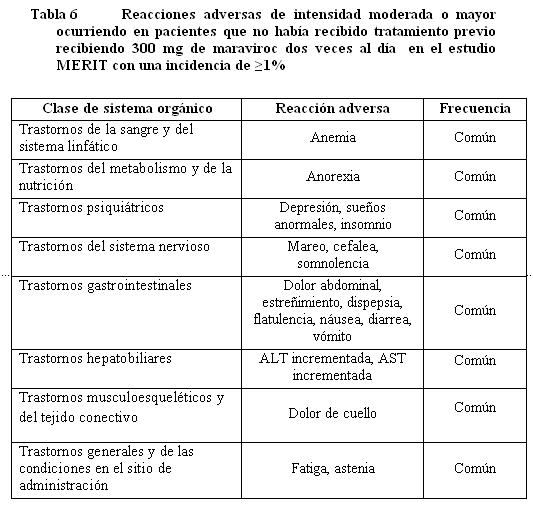
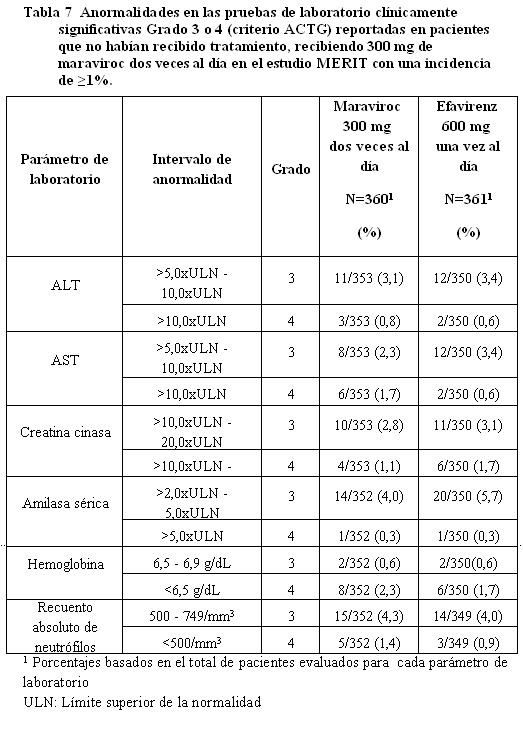
Anormalidades de laboratorio en pacientes que no habían recibido tratamiento previamente.
Otras reacciones adversas clínicamente significativas, de intensidad moderada o superior ocurrieron en menos de 1% de los pacientes adultos recibiendo maraviroc en estudios Fase 2b/3 incluyendo Síndrome de Stevens-Johnson. En pacientes infectados con VIH con deficiencia inmunitaria grave, puede surgir una reacción inflamatoria a infecciones oportunistas asintomáticas o residuales al momento de iniciar la terapia antirretroviral combinada (CART) (referirse a Advertencias y Precauciones). Información post comercialización: Muy ocasionalmente, se han reportado, reacciones de hipersensibilidad severas incluyendo rash medicamentoso con eosinofilia y síntomas sistémicos (DRESS) y reacciones cutáneas severas (SJS y TEN) así como hepatotoxicidad e insuficiencia hepática con características alérgicas en asociación con maraviroc en estudios clínicos y post comercialización.
Advertencias.
Seguridad hepática: Se ha observado un incremento en las reacciones adversas hepáticas con maraviroc durante los estudios con sujetos con infección por VIH que ya habían recibido tratamiento, a pesar de que no existió un incremento global en las anormalidades de las pruebas de función hepática Grados 3/4 del ACTG (referirse a Reacciones Adversas). Existieron menos casos de trastornos hepatobiliares reportados en pacientes que no habían recibido tratamiento previo y que se encontraban en tratamiento con maraviroc que en los que recibían efavirenz pero la incidencia global de eventos adversos hepáticos y las anormalidades en las pruebas de función hepática Grados 3/4 en pacientes que no habían recibido tratamiento previo fue similar entre maraviroc y efavirenz. Se han reportado casos de hepatotoxicidad e insuficiencia hepática con características alérgicas en asociación con maraviroc. Deberá considerarse poderosamente la discontinuación de maraviroc en cualquier paciente con signos o síntomas de hepatitis aguda, en particular si se sospecha de hipersensibilidad relacionada al fármaco o en pacientes con incremento en las transaminasas hepáticas combinado con rash u otros síntomas sistémicos de una potencial hipersensibilidad (ej. rash prurítico, eosinofilia o IgE elevada). Dado que existe información muy limitada en pacientes con co-infección de hepatitis B/C, deberá ejercerse especial precaución al tratar estos pacientes con maraviroc. En caso de terapia antiviral concomitante para la hepatitis B y/o C, favor de referirse también a la información del producto pertinente para estos medicamentos. Los pacientes con disfunción hepática pre-existente, incluyendo hepatitis crónica activa, pueden tener una mayor frecuencia de anormalidades en la función hepática durante la terapia antirretroviral combinada y deberán ser monitoreados conforme a la práctica estándar. La seguridad y eficacia de maraviroc no ha sido estudiada específicamente en pacientes con trastornos hepáticos subyacentes significativos. Dado que existe una experiencia limitada en pacientes con una función hepática reducida, maraviroc deberá usarse con precaución en esta población (referirse a Dosificación y Farmacocinética). Reacciones cutáneas y de hipersensibilidad graves: Se han reportado reacciones de hipersensibilidad incluyendo eventos graves y potencialmente riesgosos para la vida en pacientes tomando maraviroc, en la mayoría de los casos en forma concomitante con otros fármacos asociados con estas reacciones. Estas reacciones estuvieron caracterizadas por aspectos que incluyeron rash, hallazgos constitucionales, y algunas veces disfunción orgánica e insuficiencia hepática. Se han reportado casos de síndrome de Stevens-Johnson (SJS), necrólisis epidérmica tóxica (TEN) y rash medicamentoso con eosinofilia y síntomas sistémicos (DRESS) (referirse a Reacciones Adversas). Discontinúe maraviroc y otros agentes sospechosos inmediatamente si se desarrollan signos o síntomas de reacciones cutáneas o de hipersensibilidad graves. El retardo en la detención del tratamiento con maraviroc o con otros fármacos sospechosos después del establecimiento del rash puede tener como resultado una reacción que ponga en riesgo la vida. Deberá monitorearse el estado clínico incluyendo a las aminotransferasas hepáticas y la terapia apropiada iniciada. Seguridad cardiovascular: Utilícese con precaución en pacientes con un riesgo incrementado de eventos cardiovasculares. Durante los estudios Fase 3 en pacientes que habían recibido tratamiento previamente, con virus con tropismo CCR5, diez sujetos (1,2%) que recibieron maraviroc (en comparación con ninguno en el grupo placebo) presentaron eventos de cardiopatía isquémica [seis pacientes (1,4%) en el grupo de maraviroc una vez al día y cuatro pacientes (0,9%) en el grupo de dos veces al día]. Estos sujetos generalmente tenían cardiopatías o factores de riesgo cardíacos antes del uso de maraviroc, y la contribución relativa de maraviroc a estos eventos se desconoce. En el estudio Fase 2b/3 en pacientes que no habían recibido tratamiento previamente, tres sujetos (0,8%) que recibieron maraviroc presentaron eventos relacionados con cardiopatías isquémicas y cinco sujetos (1,4%) que recibieron efavirenz presentaron dichos eventos (exposición total 506 y 508 pacientes-años para maraviroc y efavirenz, respectivamente). Cuando se administró maraviroc en estudios con voluntarios sanos a dosis más elevadas que la dosis recomendada, se observaron casos de hipotensión postural sintomática con mayor frecuencia que con el placebo. Sin embargo, cuando se administró maraviroc a la dosis recomendada a pacientes infectados con VIH en estudios Fase 3, se observó hipotensión postural en una proporción similar en comparación con el placebo/comparador. Deberá tenerse precaución cuando se administre maraviroc a pacientes con un historial de hipotensión postural o que estén recibiendo medicamentos concomitantes que se sepa disminuyan la presión sanguínea. Insuficiencia Renal: Un estudio evaluó la farmacocinética y seguridad de maraviroc en sujetos con distintos grados de insuficiencia renal en comparación con voluntarios sanos. En este estudio se observaron disminuciones transitorias en la media de la depuración de creatinina en sujetos con insuficiencia renal leve a moderada así como en los voluntarios sanos que recibieron 150 mg de maraviroc (Frecuencia de dosificación: voluntarios sanos - una vez cada 12 horas; insuficiencia leve - una vez cada 24 horas; insuficiencia moderada - una vez cada 48 horas) y saquinavir/ritonavir 1000/100 mg dos veces al día la cual se resolvió con la dosificación continuada. No existió una relación entre la disminución en la media de la depuración de creatinina, y la creatinina sérica basal media. En general, maraviroc fue bien tolerado en este estudio reportándose más eventos adversos (la mayoría leves) en sujetos con insuficiencia renal leve a moderada recibiendo maraviroc y saquinavir/ritonavir. Puede ocurrir un incremento en el riesgo de hipotensión postural en pacientes con insuficiencia renal grave que sean tratados con inhibidores de la proteasa potenciados (PIs) y maraviroc. Éste riesgo se debe al incremento potencial en las concentraciones máximas de maraviroc cuando maraviroc se co-administra con PIs potenciados en estos pacientes. El riesgo de hipotensión postural es mayor cuando maraviroc se co-administra con PIs que tengan el más potente efecto inhibitorio sobre la CYP3A (saquinavir/ ritonavir, darunavir/ ritonavir lopinavir/ ritonavir). Los pacientes con función renal deteriorada pueden presentar frecuentemente co-morbilidades cardiovasculares, y pueden encontrarse en un mayor riesgo de eventos adversos cardiovasculares que sean disparados por la hipotensión postural. No se han realizado estudios con sujetos con insuficiencia renal grave co-tratados con inhibidores potentes de la CYP3A. Los ajustes en los intervalos de dosificación se basan en modelos y simulaciones farmacocinéticas. Se proporcionan guías para el ajuste de la dosis y/o del intervalo para pacientes con insuficiencia renal con y sin inhibidores potentes de la CYP3A co-administrados en Dosificación, Interacciones y Farmacocinética). Síndrome de Reconstitución Inmune: En pacientes infectados con VIH con deficiencia inmune grave al momento del inicio de la terapia antirretroviral altamente activa (HAART), puede surgir una reacción inflamatoria a patógenos oportunistas asintomáticos o residuales y causar condiciones clínicas graves, o agravamiento de los síntomas. Normalmente, dichas reacciones se han observado dentro de las primeras semanas o meses de inicio de la HAART. Ejemplo relevantes son retinitis por citomegalovirus, infecciones micobacterianas generalizadas y/o localizadas, y neumonía causada por Pneumocystis jiroveci (conocido anteriormente como Pneumocystis carinii). Cualquier síntoma inflamatorio deberá ser evaluado y se deberá iniciar tratamiento cuando sea necesario. Tropismo: Maraviroc debe ser tomado como parte de un régimen antirretroviral combinado. En condiciones óptimas maraviroc deberá ser combinado con otros antirretrovirales a los que sea susceptible el virus del paciente (referirse a Farmacodinamia). Maraviroc solamente deberá utilizarse cuando se detecta VIH-1 con tropismo CCR5 (es decir que no se detecten virus con tropismo CXCR4 o dual/mixto) determinado por un método de detección adecuadamente validado y sensible (referirse a Indicaciones, Dosificación y Farmacodinamia). El tropismo viral no puede predecirse a partir del historial de tratamiento o determinarse a partir de muestras almacenadas; sólo puede usarse una muestra fresca del paciente para determinar el tropismo viral. En pacientes infectados con VIH-1 pueden ocurrir cambios en el tropismo viral a través del tiempo. Por lo tanto, es necesario iniciar la terapia poco después de la prueba de tropismo. Ajuste de la dosis: Los médicos deben asegurarse de que se haga un ajuste adecuado de la dosis de maraviroc cuando maraviroc se co-administre con inhibidores y/o inductores de la CYP3A dado que pueden afectarse las concentraciones y/o los efectos terapéuticos del maraviroc (referirse Dosificación e Interacciones). Referirse a la información de producto respectiva de los demás medicamentos usados en combinación con maraviroc. Información para Pacientes: Debe advertirse a los pacientes que las terapias antirretrovirales incluyendo al maraviroc no han mostrado evitar el riesgo de transmisión de VIH a los demás mediante contacto sexual o contaminación con sangre. Ellos deben continuar usando las precauciones apropiadas. También deberá informarse a los pacientes que el maraviroc no es una cura para la infección por VIH-1.
Interacciones.
Maraviroc es un sustrato de la CYP3A4 del citocromo P450. La co-administración de maraviroc con medicamentos que induzcan a la CYP3A puede disminuir las concentraciones de maraviroc y reducir sus efectos terapéuticos. La co-administración de maraviroc con medicamentos que inhiban a la CYP3A puede incrementar las concentraciones plasmáticas de maraviroc. Se recomienda un ajuste de la dosis de maraviroc cuando maraviroc se co-administre con inhibidores y/o inductores de la CYP3A. A continuación se proporcionan mayores detalles de medicamentos administrados en forma concomitante (ver, Advertencias). Estudios en microsomas hepáticos humanos y sistemas enzimáticos recombinantes han demostrado que el maraviroc no inhibe a ninguna de las enzimas P450 principales a concentraciones clínicamente relevantes (CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 y CYP3A4). Maraviroc no tiene un efecto clínico relevante sobre la farmacocinética del midazolam, los anticonceptivos orales etinilestradiol y levonorgestrel, o la tasa urinaria 6b-hidroxicortisol/cortisol, sugiriendo que no hay inhibición o inducción de la CYP3A4 in vivo. A pesar de la ausencia de inhibición de la CYP2D6 in vitro, el maraviroc causó incremento en la tasa metabólica de debrisoquina a 600 mg una vez al día a pesar de que no ocurrió a 300 mg dos veces al día. Por lo tanto, no puede excluirse una inhibición potencial de la CYP2D6 a una mayor exposición a maraviroc. Con base en la información in vitro y clínica, el potencial de maraviroc de afectar la farmacocinética de los medicamentos co-administrados es baja. La depuración renal es responsable de aproximadamente 23% de la eliminación total de maraviroc cuando el maraviroc se administra sin inhibidores de la CYP3A. Dado que se involucran procesos tanto activos como pasivos, existe el potencial de una competencia por la eliminación con otros principios activos eliminados por vía renal. Sin embargo, la co-administración de maraviroc con tenofovir (sustrato para eliminación renal) y con Cotrimoxazol (contiene trimetoprima, un inhibidor del transporte catiónico renal), no mostró efecto sobre la farmacocinética del maraviroc. Además, la co-administración de maraviroc con lamivudina/zidovudina no mostró efectos del maraviroc sobre la farmacocinética de la lamivudina (eliminada principalmente por vía renal) o de la zidovudina (metabolismo no-P450 y eliminación renal). Maraviroc inhibe a la glicoproteína P in vitro (el IC50 es 183 mM). Sin embargo, maraviroc no afecta significativamente la farmacocinético de la digoxina in vivo, sugiriendo que maraviroc no inhibe ni induce la actividad de la glicoproteína-P.

Embarazo y lactancia: Fertilidad: No existe información sobre los efectos del maraviroc sobre la fertilidad humana. En ratas, no existieron efectos adversos sobre la fertilidad de machos o hembras (referirse a la Información Preclínica). Embarazo: No se cuenta con información clínica significativa sobre la exposición durante el embarazo. Los estudios con animales no indican efectos dañinos directos o indirectos con respecto al embarazo, desarrollo embrional /fetal, parto o desarrollo postnatal (referirse a Información Preclínica). Solo deberá usarse maraviroc durante el embarazo si el beneficio potencial justifica el riesgo potencial para el feto. Lactancia: Los estudios con ratas lactando indican que el maraviroc es extensamente excretado en la leche de ratas. Se desconoce si el maraviroc se excreta en la leche humana. Se deberá dar instrucciones a las madres de que no amamanten si están recibiendo maraviroc debido al potencial de transmisión del VIH y cualquier posible efecto indeseable en los lactantes. Capacidad para realizar tareas que requieran habilidades de juicio, motoras o cognitivas: No existen estudios que investiguen el efecto del maraviroc sobre la capacidad para realizar tareas que requieran habilidades de juicio, motoras o cognitivas. Sin embargo, deberá informarse a los pacientes acerca de la posible aparición de síntomas relacionados con la hipotensión postural como mareos cuando tomen maraviroc. Si resultan afectados, los pacientes deberán evitar tareas potencialmente peligrosas como conducir u operar maquinaria.
Incompatibilidades.
No se aplica.
Conservación.
Almacenar a no más de 30°C. Vida útil: La fecha de caducidad viene indicada en el empaque. Precauciones especiales de eliminación y manipulación del producto: Sin requerimientos especiales.
Sobredosificación.
Síntomas y signos: La mayor dosis administrada en estudios clínicos fue de 1.200 mg. La reacción adversa limitante de la dosis fue la hipotensión postural. Se observó prolongación del intervalo QT en perros y monos a concentraciones plasmáticas 6 a 12 veces superiores, respectivamente, con respecto a aquellas esperadas en humanos a la dosis máxima recomendada de 300 mg dos veces al día. Sin embargo, no se observó una prolongación clínicamente significativa de QT en comparación al OBT solo en estudios clínicos Fase 3 usando la dosis recomendada de maraviroc ni en un estudio farmacocinético específico para evaluar el potencial de maraviroc para prolongar el intervalo QT. Tratamiento: No existe un antídoto específico para la sobredosis con maraviroc. El tratamiento de la sobredosis debería consistir en medidas generales de soporte incluyendo mantener al paciente en posición supina, valoración cuidadosa de los signos vitales, presión sanguínea y ECG del paciente. Si está indicado, la eliminación del maraviroc activo no absorbido deberá hacerse por emesis. También puede usarse la administración de carbón activado para ayudar a la remoción de la sustancia activa no absorbida. Dado que el maraviroc se une moderadamente a las proteínas, la diálisis puede resultar beneficiosa para retirar este medicamento. El manejo ulterior deberá ser como lo recomiende el centro nacional de envenenamiento, donde se encuentre disponible.
Presentación.
Blíster de PVC/Aluminio, en estuche de cartulina que contiene 60 comprimidos recubiertos.

